
Organon mexicana, s
INFORMACIÓN PARA PRESCRIBIR AMPLIA
Acetato de Nomegestrol / Estradiol
1. NOMBRE COMERCIAL: ZOELY®
2. NOMBRE GENÉRICO: Acetato de Nomegestrol / Estradiol
3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas
Cada tableta contiene:
Acetato de nomegestrol
Excipientes c.b.p.
Las tabletas amaril as no contienen sustancias activas placebo.
Las tabletas activas son blancas, redondas de 5.5 mm de diámetro. Tienen el código "ne" en
Las tabletas placebo son amaril as, redondas de 5.5 mm de diámetro. Tienen el código "p" en
4. INDICACIONES TERAPÉUTICAS: Anticonceptivo oral.
5. FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades Farmacocinéticas
Acetato de nomegestrol
El acetato de nomegestrol administrado por vía oral se absorbe rápidamente.
Las concentraciones plasmáticas máximas de acetato de nomegestrol son de alrededor de 7
ng/mL se alcanzan 2h después de la administración única. La biodisponibilidad absoluta del
acetato de nomegestrol después de una dosis única es del 63%. No se observó un efecto
clínicamente relevante de los alimento sobre la biodisponibilidad de acetato de nomegestrol.
El acetato de nomegestrol se une fuertemente a la albúmina (97-98%), pero no se une a la
globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés) o globulina de unión
a corticoides (CBG, por sus siglas en inglés). El volumen de distribución aparente en estado
estable es de 1,645 ± 576 l.
Biotransformación
El acetato de nomegestrol se metaboliza en diversos metabolitos hidroxilados inactivos por las
enzimas hepáticas del citocromo P450, principalmente CYP3A4 y CYP3A5 con una posible
contribución de CYP2C19 y CYP2C8. El acetato de nomegestrol y sus metabolitos hidroxilados
atraviesan un extenso metabolismo de fase 2 para formar conjugados glucurónidos y sulfato.
La depuración aparente en estado estable es de 26 L/h.
La vida media de eliminación (t1/2) es de 46h (rango de 28-83 h) en estado estable. No se
determinó la vida media de eliminación de los metabolitos.
El acetato de nomegestrol se excreta por la orina y las heces. Aproximadamente 80% de la
dosis se excreta en la orina y las heces antes de 4 días. La excreción es casi total después de
10 días y las cantidades excretadas fueron mayores en las heces que en la orina.
Se observó linealidad de dosis en el rango de 0.625–5 mg (evaluado en mujeres fértiles y
posmenopáusicas).
Condiciones en estado estable
Las farmacocinéticas del acetato de nomegestrol no son influenciadas por SHBG.
El estado estable se alcanza después de 5 días. Las concentraciones plasmáticas máximas de
acetato de nomegestrol de alrededor de 12 ng/mL se alcanzan 1.5 h después de la dosis. Las
concentraciones plasmáticas promedio en estado estable son de 4 ng/ml.
Interacciones farmacológicas
El acetato de nomegestrol no provoca una inducción o inhibición in vitro notables de alguna
enzima del citocromo P450 y no tiene interacción clínicamente relevante con el transportador
Estradiol (E2)
El estradiol se somete a un efecto de primer paso substancial luego de la administración oral.
La biodisponibilidad absoluta es de aproximadamente 1%. No se observó un efecto
clínicamente relevante de los alimentos sobre la biodisponibilidad de estradiol.
La distribución del estradiol exógeno y endógeno es similar. Los estrógenos se distribuyen
ampliamente en el cuerpo y por lo general se encuentran en mayores concentraciones en los
órganos objetivo de las hormonas sexuales. El estradiol circula en la sangre unida a SHBG
(37%) y a la albúmina (61%), mientras que sólo aproximadamente 1-2 % permanece libre.
Biotransformación
El estradiol exógeno oral se metaboliza extensamente. El metabolismo del estradiol exógeno y
endógeno es similar. El estradiol se transforma rápidamente en el intestino e hígado en
diversos metabolitos, principalmente estrona, que posteriormente se conjuga y experimenta
circulación entero-hepática. Existe un equilibrio dinámico entre estradiol, estrona y estrona-
sulfato debido a diversas actividades enzimáticas, incluyendo estradiol-dehidrogenasas,
sulfotransferasas y aril sulfatasas. La oxidación de estrona y estradiol involucra a las enzimas
del citocromo P450, principalmente CYP1A2, CYP1A2 (extra hepática), CYP3A4, CYP3A5 y
CYP1B1, y CYP2C9.
El estradiol se elimina rápidamente de la circulación. Debido al metabolismo y circulación
enterohepática, un gran grupo de sulfatos de estrógeno y glucurónidos está presente. Esto
resulta en una vida media de eliminación de estradiol, corregida para los valores iniciales,
altamente variable, que se calcula en 3.6 ± 1.5 h, después de la administración intravenosa.
Condiciones en estado estable
Las concentraciones séricas máximas de estradiol son de alrededor de 90 pg/mL y se
alcanzan 6 h después de la dosis. Las concentraciones séricas promedio son de 50 pg/mL y
estos niveles de estradiol corresponden a la fase temprana y tardía del ciclo menstrual de una
Poblaciones especiales
Población pediátrica
Las farmacocinéticas de acetato de nomegestrol (objetivo primario) después de la dosis oral
única de ZOELY® en mujeres adolescentes post menárquicas y adultas fueron similares. La
exposición de estradiol (objetivo secundario) fue similar en adolescentes versus sujetos
adultos durante las primeras 24 horas, y menor después de 24 horas. Se desconoce la
relevancia clínica de este resultado.
Si bien es cierto que en algunas regiones hay embarazos en adolescentes su utilización en el
grupo de edad deberá ser bajo control médico estricto y recetado por médico especialista en
virtud de que no hay estudios clínicos que avalen su utilización en adolescentes.
Efecto de la insuficiencia renal
No se realizaron estudios para evaluar el efecto de la enfermedad renal sobre la farmacocinética de ZOELY®.
Efecto de la insuficiencia hepática
No se realizaron estudios para evaluar el efecto de la enfermedad hepática sobre la
farmacocinética de ZOELY®. Sin embargo, las hormonas esteroides podrían ser mal
metabolizadas en mujeres con una función hepática deteriorada.
Grupos étnicos
No se realizaron estudios formales para evaluar las farmacocinéticas en grupos étnicos.
Propiedades Farmacodinámicas
Grupo farmacoterapéutico: moduladores de hormonas sexuales del sistema genital,
progestágenos y estrógenos, combinaciones fijas, código ATC: G03AA14
El acetato de nomegestrol es un progestágeno altamente selectivo derivado de la hormona
esteroide que se presenta de forma natural, progesterona. El acetato de nomegestrol tiene
una fuerte afinidad por el receptor de la progesterona humana y tiene actividad anti
gonadotrópica, moderada actividad anti androgénica, y está desprovisto de alguna actividad
estrogénica, androgénica, glucocorticoide o mineralocorticoide.
El estrógeno contenido en ZOELY® es 17β-estradiol, un estrógeno natural idéntico al
endógeno humano 17β-estradiol (E2). Este estrógeno difiere del estrógeno etinilestradiol
utilizado en otros COC por su falta de grupo etinil en la posición 17alfa. Durante el uso de
ZOELY®, los niveles promedio de E2 son comparables a los niveles de E2 durante la fase
folicular temprana y luteal tardía del ciclo menstrual (vea propiedades farmacocinéticas).
El efecto anticonceptivo de ZOELY® se basa en la interacción de diversos factores, los más
importantes se observan como la inhibición de ovulación y los cambios en la secreción
En dos estudios con distribución al azar, abiertos, comparativos de seguridad – eficacia, más
de 3,200 mujeres de 18-50 años de edad recibieron tratamiento hasta por 13 ciclos
consecutivos con ZOELY® y más de 1,000 mujeres con 3 mg de drospirenona – 30 μg de
etinilestradiol (esquema 21/7).
En el grupo de ZOELY®, 8.6% de las mujeres refirió aumento de peso (versus 5.7% en el
grupo comparador), 10.5% de las mujeres (versus 0.5% en el grupo comparador) refirió
sangrado irregular por deprivación (predominantemente ausencia de sangrado por
deprivación) y acné fue informado por 15.4% de las mujeres (versus 7.9% en el grupo
comparador) (vea Efectos indeseables). Las evaluaciones de acné durante el tratamiento con
ZOELY® demostraron que la mayoría de las mujeres (73.1%) no tienen cambio en el estatus
de acné en comparación con los valores iniciales mientras que 16.8% tenía mejoras en el
acné y 10.1% presentaba nuevo acné o agravamiento de este.
En el estudio clínico realizado con ZOELY® en la Unión Europea, Asia y Australia, se
calcularon los siguientes Índices de Pearl para el intervalo de 18-35 años de edad:
Fracaso del método: 0.40 (límite superior del IC del 95% 1.03)
Fracaso del método y del usuario: 0.38 (límite superior del IC del 95% 0.97)
En el estudio clínico realizado con ZOELY® en los Estados Unidos, Canadá y Latinoamérica, se
calcularon los siguientes Índices de Pearl para el intervalo de 18-35 años de edad:
Fracaso del método: 1.22 (límite superior del IC del 95% 2.18)
Fracaso del método y del usuario: 1.16 (límite superior del IC del 95% 2.08)
En un estudio abierto, con distribución al azar, 32 mujeres fueron tratadas durante 6 ciclos
Después de la interrupción de ZOELY®, el regreso a la ovulación se presentó en promedio a
los 20.8 días después de tomar la última tableta, las primeras ovulaciones se detectaron a los
El ácido fólico es una importante vitamina en la fase temprana del embarazo. Los niveles
séricos de ácido fólico permanecieron sin cambio durante y después del tratamiento con
ZOELY® por 6 ciclos consecutivos, comparado con los valores iniciales.
En un estudio comparativo, de abierto, con distribución al azar, de dos años, mujeres de 21-
35 años de edad recibieron tratamiento con ZOELY® sin efectos clínicamente relevantes sobre
la densidad mineral ósea.
Se l evó a cabo un estudio comparativo, abierto, con distribución al azar, para evaluar los
efectos de ZOELY® en la hemostasis, metabolismo de carbohidratos y lípidos, función
adrenal, tiroidea y sobre los andrógenos. Sesenta mujeres de entre 18-50 años de edad
recibieron tratamiento con ZOELY® durante 6 ciclos consecutivos. La tolerancia a la glucosa y
la sensibilidad a la insulina permanecieron sin cambio y no se observaron efectos clínicamente
relevantes con ZOELY® sobre el metabolismo de lípidos y hemostasis. ZOELY® incrementó
las proteínas portadoras TBG y CBG e indujo un pequeño incremento en SHBG. Los
parámetros androgénicos androstenediona, DHEA-S, testosterona libre y total se redujeron
significativamente durante el uso de ZOELY®.
Se investigó la histología endometrial en un subgrupo de mujeres (n=32) en un estudio clínico
después de 13 ciclos de tratamiento. No hubo resultados anormales.
Población pediátrica
No hay datos disponibles sobre eficacia y seguridad en adolescentes de menos de 18 años de
edad. La información farmacocinética disponible se describe en la sección propiedades
farmacodinámicas.
6. CONTRAINDICACIONES.
Los anticonceptivos hormonales combinados (COC) no deben utilizarse en presencia de
cualquiera de las condiciones mencionadas a continuación. Debido a que aún no hay datos
epidemiológicos disponibles con COC que contienen 17β-estradiol, las contraindicaciones para
COC que contienen etinilestradiol se consideran aplicables también al uso de ZOELY®. Si
alguna de las condiciones aparece por primera vez durante el uso de ZOELY®, el
medicamento debe suspenderse de inmediato.
• Hipersensibilidad a las substancias activas o a cualquiera de los excipientes de
• Presencia o antecedentes de trombosis venosa (trombosis venosa profunda, embolia
• Presencia o antecedentes de trombosis arterial (por ej. infarto de miocardio) o
condiciones prodrómicas (por ej., ataque isquémico transitorio, angina de pecho).
• Presencia o antecedentes de accidente cerebrovascular.
• Historial de migraña con síntomas neurológicos focales.
• Presencia de factores de riesgo múltiples o severos para trombosis arterial o venosa
Diabetes Mel itus con síntomas vasculares;
No debe utilizarse en pacientes con hipertensión arterial descontrolada;
Dislipoproteinemia severa.
• Predisposición hereditaria o adquirida para trombosis arterial o venosa, tales como
resistencia a la proteína C activada (APC, por sus siglas en inglés), deficiencia de
antitrombina-III, deficiencia de proteína C, deficiencia de proteína S,
hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina,
anticoagulante del lupus).
• Pancreatitis o antecedentes de esta, si está asociada con hipertrigliceridemia severa.
• Presencia o antecedentes de padecimiento hepático severo en tanto los valores de
función hepática no regresen a la normalidad.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Certeza o sospecha de malignidades influenciadas por esteroide sexual (por ej. de los
órganos genitales o mamas).
• Certeza o sospecha de embarazo
7. PRECAUCIONES GENERALES:
Si se presenta cualquiera de los factores de riesgo / condiciones mencionados a continuación,
deben evaluarse individualmente los beneficios del uso de ZOELY® contra los posibles riesgos
para cada caso, y estos deben discutirse con la paciente antes de que el a decida empezar a
utilizar ZOELY®. En caso de agravamiento, exacerbación o aparición por primera vez de
cualquiera de estas condiciones o factores de riesgo, la paciente debe contactar a su médico.
El médico debe entonces decidir si ZOELY® debe o no interrumpirse. Todos los datos
presentados a continuación se basan en datos epidemiológicos obtenidos con anticonceptivos
orales combinados (COC) que contienen etinilestradiol. Debido a que aún no hay datos
epidemiológicos disponibles con COC que contienen 17β-estradiol, las advertencias se consideran aplicables para el uso de ZOELY®.
Trastornos circulatorios
Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos
con COC que contienen etinilestradiol. ZOELY® contiene 17β-estradiol. Debido a que aún no
hay datos epidemiológicos disponibles con COC que contienen 17β-estradiol, las advertencias
se consideran aplicables para el uso de ZOELY®.
• El uso de algún COC conl eva un incremento en el riesgo de tromboembolismo venoso
(VTE, por sus siglas en inglés), en comparación con su no uso. El riesgo de VTE es
mayor durante el primer año en que una mujer utiliza por primera vez un
anticonceptivo oral combinado.
• Los estudios epidemiológicos que la incidencia de VTE en las mujeres sin factores de
riesgo conocidos para VTE quienes usan dosis bajas de anticonceptivos orales
combinados (<50 µg de etinilestradiol) con estrógeno varía de 20 a 40 casos por cada
100,000 mujeres al año. Esto se compara con 5 a 10 casos por cada 100,000 mujeres
al año para las no usuarias y 60 casos por cada 100,000 embarazos. La VTE es fatal
en 1-2% de los casos.
Se desconoce cómo ZOELY® influencia el riesgo en comparación con otros COC.
• Los estudios epidemiológicos han asociado también el uso de COC con un aumento en
el riesgo de tromboembolia arterial (infarto de miocardio, ataque isquémico
• En casos extremadamente raros, se ha referido la presencia de trombosis en otros
vasos sanguíneos, por ej. venas y arterias hepáticas, mesentéricas, renales, cerebrales
o retinales, en usuarias de COC. No existe un consenso en cuanto a si la incidencia de
estos eventos está asociada o no con el uso de COC.
• Los síntomas de trombosis arterial o venosa o de un accidente cerebrovascular pueden
incluir: dolor unilateral y/o inflamación en las piernas; dolor severo súbito en el pecho,
ya sea que provenga o no del brazo izquierdo; dificultades respiratorias súbitas;
ataques repentinos de tos; cualquier cefalea inusual, severa o prolongada; pérdida de
visión parcial o completa súbita; diplopia; problemas de dicción o afasia; vértigo;
colapso con o sin convulsiones focales; debilidad o entumecimiento muy marcado que
afecta repentinamente un lado o una parte del cuerpo; trastornos motores; abdomen
• El riesgo de eventos de tromboembolismo venoso aumenta con:
un historial familiar positivo (es decir, cualquier tromboembolismo venoso en
un hermano o padre a una edad relativamente temprana). Si se sospecha una
predisposición hereditaria, la mujer debe consultar a un especialista antes de
decidir sobre el uso de un anticonceptivo hormonal;
inmovilización prolongada, cirugía mayor, cualquier cirugía en piernas o trauma
mayor. En estas situaciones, es aconsejable interrumpir el uso (en caso de una
cirugía electiva, por lo menos 4 semanas antes) y no retomar hasta dos
semanas después de recuperar completamente la movilidad.
obesidad (índice de masa corporal mayor a 30 kg/m2).
• No hay un consenso acerca del posible papel de las venas varicosas y tromboflebitis
superficial en el inicio de la trombosis venosa.
• El riesgo de complicaciones tromboembólicas arteriales o de un accidente
cerebrovascular aumenta con:
tabaquismo (el tabaquismo y la edad aumentan el riesgo aún más,
especialmente en mujeres de mayores de 35 años de edad. Debe aconsejarse
a las mujeres de más de 35 años de edad que no fumen si desean utilizar un
dislipoproteinemia;
obesidad (índice de masa corporal mayor a 30 kg/m2);
enfermedad valvular cardiaca;
fibrilación atrial;
un historial familiar positivo (es decir, cualquier tromboembolismo venoso en
un hermano o padre a una edad relativamente temprana). Si se sospecha una
predisposición hereditaria, la mujer debe consultar a un especialista antes de
decidir sobre el uso de un anticonceptivo hormonal.
• Otras condiciones médicas que han sido asociadas con eventos circulatorios adversos,
incluyen diabetes mel itus, lupus eritematoso sistémico, síndrome urémico hemolítico,
enfermedad intestinal inflamatoria crónica (por ejemplo, enfermedad de Crohn o colitis
ulcerosa) y enfermedad de células falciformes.
• Debe considerarse el aumento en el riesgo de tromboembolismo en el puerperio (para
información sobre "Embarazo y lactancia").
• Un incremento en la frecuencia o gravedad de la migraña (que podría ser prodrómico
de un evento cerebrovascular) podría ser motivo de la interrupción inmediata del uso
A las mujeres que utilizan COC se les debe indicar específicamente que contacten a su médico
en caso de posibles síntomas de trombosis. En caso de sospecha o confirmación de trombosis,
el uso de COC debe interrumpirse. Debe iniciarse una anticoncepción adecuada debido a la
teratogenicidad de la terapia anticoagulante (coumarinas).
Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos
con COC que contienen etinilestradiol. ZOELY® contiene 17β-estradiol. Debido a que aún no
hay datos epidemiológicos disponibles con COC que contienen 17β-estradiol, las advertencias
se consideran aplicables para el uso de ZOELY®.
• El factor de riesgo más importante para el cáncer cervical es la infección persistente
por virus del papiloma humano (VPH). Los estudios epidemiológicos indican que el uso
a largo plazo de COC que contienen etinilestradiol contribuye a este aumento del
riesgo, pero la incertidumbre continúa acerca del grado en que este hal azgo es
atribuible a efectos que son confusos, como el aumento de los exámenes cervicales y
la diferencia en el comportamiento sexual, incluyendo el uso de anticonceptivos de
barrera, o una asociación causal.
• Con el uso de los COC de dosis más elevadas (50 μg de etinilestradiol) el riesgo de
cáncer endometrial y de ovarios se reduce. Si esto aplica también a los COC que
contienen 17β-estradiol está aún por confirmarse.
• Un meta-análisis de 54 estudios epidemiológicos informó que existe un ligero aumento
en el riesgo relativo (RR= 1.24) de tener cáncer de mama diagnosticado en mujeres
quienes actualmente usan un COC que contiene etinilestradiol. Este mayor riesgo
desaparece de manera paulatina durante el transcurso de 10 años posteriores al cese
del uso de COC. Debido a que el cáncer de mama es raro en mujeres menores de 40
años de edad, el excedente en el número de diagnósticos de cáncer de mama en las
usuarias presentes y recientes de COC es pequeño en relación al riesgo total de cáncer
de mama. Los cánceres de mama diagnosticados en mujeres que alguna vez fueron
usuarias tienden a ser menos avanzados clínicamente que los cánceres diagnosticados
en aquel as quienes nunca han sido usuarias. El patrón observado de aumento de
riesgo podría deberse a un diagnóstico más temprano de cáncer de mama en usuarias
de COC, a los efectos biológicos de los COC, o a una combinación de ambos.
• En casos raros, se han informado tumores hepáticos benignos y en ocasiones aún más
raras, se han informado tumores hepáticos malignos en usuarias de COC. En casos
aislados, estos tumores han l evado a hemorragias intra abdominales potencialmente
letales. Por lo tanto, debe considerarse un tumor hepático sólido en el diagnóstico
diferencial cuando se presenta dolor abdominal superior severo, agrandamiento
hepático o signos de hemorragias intra abdominal en mujeres que toman COC.
Otras condiciones
Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos
con COC que contienen etinilestradiol. ZOELY® contiene 17β-estradiol. Debido a que aún no
hay datos epidemiológicos disponibles con COC que contienen 17β-estradiol, las advertencias
se consideran aplicables para el uso de ZOELY®.
• Las mujeres con hipertrigliceridemia, o antecedentes familiares de esta, podrían tener
un mayor riesgo de sufrir pancreatitis cuando utilizan COC.
• Aunque se han referido pequeños incrementos en la presión arterial en muchas
mujeres quienes toman COC, los aumentos clínicamente relevantes son raros. No se
ha establecido una relación entre el uso de COC e hipertensión clínica. Sin embargo, si
se desarrol a una hipertensión clínicamente sostenida durante el uso de un COC, es
prudente entonces que el médico suspenda la ingesta de las tabletas y trate la
hipertensión. Cuando lo considere apropiado, puede reiniciarse el uso de COC si
pueden alcanzarse valores normotensivos con la terapia antihipertensiva.
En siete estudios clínicos multicéntricos de hasta un año de duración, no se
observaron cambios clínicamente relevantes en la presión arterial con el uso de
• Se ha informado que las siguientes condiciones se presentan o deterioran tanto con el
embarazo como con el uso de COC, pero la evidencia de una asociación con el uso de
COC no es concluyente: ictericia y/o prurito relacionado con colestasis; formación de
cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico;
corea de Sydenham; herpes gestacional; pérdida del oído relacionada con otosclerosis.
• En mujeres con angioedema hereditario, los estrógenos exógenos podrían inducir o
exacerbar los síntomas de angioedema.
• Las alteraciones crónicas o agudas de la función hepática podrían requerir la
interrupción del uso de COC hasta que los marcadores de función hepática regresen a
la normalidad. La recurrencia de ictericia colestática que se presenta por primera vez
durante el embarazo o uso previo de esteroides sexuales requiere la interrupción de
• Aunque los COC podrían tener un efecto sobre la resistencia periférica a la insulina y
tolerancia a la glucosa, no hay evidencia de una necesidad de alterar el esquema
terapéutico en diabéticos quienes utilizan dosis bajas de COC (que contienen <0.05
mg de etinilestradiol). Sin embargo, las mujeres diabéticas deben ser cuidadosamente
monitoreadas mientras toman un COC, especialmente en los primeros meses de uso.
ZOELY® demostró no tener efecto en la resistencia periférica a la insulina y tolerancia
a la glucosa en mujeres sanas.
• El agravamiento de la depresión, la enfermedad de Crohn y la colitis ulcerosa han sido
asociadas al uso de COC.
• Podría presentarse ocasionalmente cloasma, especialmente en mujeres con un
historial de cloasma gravídico. Las mujeres con una tendencia a cloasma deben evitar
la exposición a la radiación solar o ultravioleta mientras toman COC.
• Las pacientes con problemas hereditarios raros de intolerancia a la galactosa,
deficiencia de Lapp lactasa o absorción deficiente de glucosa-galactosa no deben
tomar este medicamento.
Examen / consulta médica
Antes del inicio o reinicio del uso de COC, debe elaborarse un historial médico completo
(incluyendo historial familiar) y el embarazo debe descartarse. Debe medirse la presión
arterial y, si está clínicamente indicado, debe l evarse a cabo un examen físico, guiado por las
contraindicaciones y advertencias. También debe indicarse a la paciente que lea
cuidadosamente el instructivo de uso para que se adhiera a las recomendaciones
proporcionadas. La frecuencia y naturaleza de las revisiones periódicas posteriores deben
basarse en los lineamientos de práctica establecidos y adaptarse a cada mujer.
Debe advertirse a las mujeres que los anticonceptivos orales no protegen contra las
infecciones por el virus de la inmunodeficiencia humana (VIH) (Síndrome de
Inmunodeficiencia Adquirida, SIDA) ni otras enfermedades de transmisión sexual.
Reducción en la eficacia
La eficacia de los COC podría verse reducida en el caso de, por ej. Tabletas faltantes
trastornos gastrointestinales durante la toma de la tableta activas o uso de medicación
Control de ciclo
Con todos los COC, podrían presentarse sangrado periovulatorio o manchado, especialmente
durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier sangrado irregular
es significativo únicamente después de un intervalo de adaptación de alrededor de tres ciclos.
El porcentaje de mujeres que utilizan ZOELY® y experimentan sangrado intracíclico después
de este periodo de adaptación varió de 15-20%.
Si las irregularidades en el sangrado persisten o se presentan después de ciclos previos
regulares, entonces deben considerarse causas no hormonales, se indican además medidas
diagnósticas adecuadas para excluir malignidad o embarazo. Estas podrían incluir legrado.
La duración del sangrado por supresión en las mujeres que utilizan ZOELY® es en promedio
de 3-4 días. Las usuarias de ZOELY® podrían también no presentar sangrado por deprivación
aunque no estén embarazadas. Durante los estudios clínicos, la ausencia de sangrado por
deprivación varió de 18% a 32% (durante los ciclos 1-12). En dichos casos, la ausencia de
sangrado por deprivación no se asoció con una mayor incidencia de sangrado periovulatorio /
manchado en ciclos posteriores. Un 4.6% de las mujeres presentaron ausencia de sangrado
por deprivación en cada uno de los primeros tres ciclos de uso. Dentro de este subgrupo, el
porcentaje de mujeres que experimentaron ausencia de sangrado por deprivación en ciclos
posteriores fue alto, varió de 76% a 87%. Del 28% de las mujeres quienes experimentaron
ausencia de sangrado por deprivación en al menos un ciclo (durante los ciclos 2, 3 o 4), 51%
a 62% de estas mujeres también experimentó ausencia de sangrado por deprivación en ciclos
Si se presenta ausencia de sangrado por deprivación y ZOELY® se está tomando según las
instrucciones descritas, es poco probable que la mujer esté embarazada. Si ZOELY® no se ha
tomado como se indica o si no se han presentado dos sangrados por deprivación
consecutivos, debe descartarse el embarazo antes de continuar con ZOELY®.
Población pediátrica
Se desconoce si la cantidad de estradiol en ZOELY® es suficiente para mantener los niveles
adecuados de estradiol en adolescentes, especialmente para la acumulación de masa ósea.
Efecto sobre la capacidad para conducir vehículos y operar maquinaria.
No se han realizado estudios con ZOELY® acerca de los efectos sobre la capacidad para
manejar y utilizar máquinas. Sin embargo, no se han observado efectos sobre la capacidad
para manejar y utilizar máquinas en usuarias de COC.
8. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
ZOELY® no está indicado durante el embarazo.
Si se presenta un embarazo durante el tratamiento con ZOELY®, debe interrumpirse su
administración. La mayoría de los estudios epidemiológicos no han revelado un mayor riesgo
de defectos de nacimiento en niños nacidos de mujeres quienes utilizaron COC que contienen
etinilestradiol, antes del embarazo, ni tampoco un efecto teratogénico cuando se tomó de
forma inadvertida COC que contienen etinilestradiol durante el inicio del embarazo.
Los datos clínicos de un número limitado de embarazos expuestos no indican un efecto
adverso de ZOELY® en el feto o neonato.
En estudios en animales, se observó toxicidad reproductiva con la combinación de acetato de
nomegestrol / estradiol.
La lactancia podría verse afectada por los COC, puesto que estos podrían reducir la cantidad,
y cambiar la composición, de la leche materna. Por lo tanto, no debe recomendarse el uso de
COC hasta que la madre haya destetado por completo a su hijo y debe proponerse un método
anticonceptivo a las mujeres que desean amamantar. Pequeñas cantidades de los esteroides
anticonceptivos y/o sus metabolitos podrían excretarse con la leche, pero no hay evidencia de
que esto afecte de forma adversa la salud del infante.
ZOELY® está indicado para la prevención del embarazo.
9. REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad
Se utilizaron siete estudios clínicos multicéntricos de hasta dos años de duración para evaluar
la seguridad de ZOELY®. En total participaron 3,490 mujeres de entre 18-50 años y
completaron 35,028 ciclos.
Resumen tabular de reacciones adversas
Las reacciones adversas posiblemente relacionadas que se han informado en usuarias de
ZOELY® se presentan en la siguiente tabla.
Todas las reacciones adversas se presentan por sistema, órgano y frecuencia; muy común (≥
1/10), común (≥ 1/100 a < 1/10), poco común (≥ 1/1,000 a < 1/100) y rara (≥ 1/10,000 a <
Reacción adversa en término MedDRA1
aumento del apetito, disminución del
retención de líquidos apetito
nutricionales Desordenes
disminución de la
aumento del libido
estado de ánimo
estado de ánimo
sistema nervioso
Desordenes oculares
resequedad ocular,
intolerancia a los
lentes de contacto
vasculares Trastornos
gastrointestinales
Desordenes de la
piel y del tejido
Desordenes músculo
esqueléticos y del
tejido conectivo Trastornos del
sistema reproductor
deprivación irregular menorragia,
de las glándulas
espasmos uterinos,
Trastornos generales
y condiciones del
administración Investigaciones
enzima hepática
1 se menciona el término MedDRA más apropiado (versión 13.1) para describir una cierta reacción adversa. Los sinónimos o
condiciones relacionadas no se mencionan, pero igualmente deben ser tomados en cuenta.
2 El acné fue un evento solicitado, más que espontáneamente referido, que se evaluó en cada visita del estudio.
Descripción de reacciones adversas seleccionadas
Se ha informado una variedad de efectos indeseables en mujeres que utilizan anticonceptivos
orales combinados que contienen etinilestradiol.
10. INTERACCIÓN MEDICAMENTOSA Y DE OTRO GÉNERO:
Influencia de otros medicamentos en ZOELY®
Las interacciones entre los anticonceptivos orales y otros medicamentos podrían l evar a
sangrado periovulatorio y hasta fracaso anticonceptivo.
Los ejemplos de sustancias activas que inducen enzimas hepáticas y por el o resultan en un
incremento en la depuración de hormonas sexuales son: fenitoína, fenobarbital, primidona,
bosentán, carbamazepina, rifampicina y medicamentos o preparaciones herbales que
contienen hierba de San Juan y, en un menor grado, oxcarbazepina, topiramato, felbamato y
griseofulvina. Además, los inhibidores de la proteasa del VIH con un potencial de inducción
(por ej. ritonavir y nelfinavir) e inhibidores de la transcriptasa inversa no nucleósidos (por ej.
nevirapina y efavirenz), podrían afectar el metabolismo hepático.
Con las substancias inductoras de las enzimas hepáticas, debe utilizarse un método de barrera
durante el tiempo que dure la administración del medicamento concomitante y 28 días más
después de su interrupción. En caso de tratamiento a largo plazo con substancias inductoras
de las enzimas hepáticas, debe considerarse otro método anticonceptivo.
No se realizaron estudios de interacción del medicamento con ZOELY®, pero se l evaron a
cabo dos estudios con rifampicina y ketoconazol, respectivamente, con una combinación de
dosis mayor de acetato de nomegestrol-estradiol (3.75mg de acetato de nomegestrol +
1.5mg de estradiol) en mujeres posmenopáusicas. El uso concomitante de rifampicina
disminuye el AUC0-∞ de acetato de nomegestrol en 95% e incrementó el AUC0-tlast de estradiol
en 25%. Se observó que el uso concomitante de ketoconazol (dosis única de 200mg) no
modifica el metabolismo de estradiol, mientras que aumenta la concentración pico (85%) y
AUC0-∞ (115%) de acetato de nomegestrol, aunque dichos cambios no tuvieron relevancia
clínica. Se esperan conclusiones similares en mujeres en edad reproductiva.
Influencia de ZOELY® en otros medicamentos
Los anticonceptivos orales pueden afectar el metabolismo de otros medicamentos. Debe
prestarse atención especial a la interacción con lamotrigina.
11. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
El uso de COC podría influenciar los resultados de ciertas pruebas de laboratorio, incluyendo
parámetros bioquímicos del hígado, tiroides, función adrenal y renal, niveles plasmáticos de
proteínas (portadoras), por ej. Globulina de unión a corticosteroides y fracciones lipídicas/de
lipoproteína, parámetros del metabolismo de carbohidrato y parámetros de coagulación y
fibrinólisis. Los cambios generalmente se mantienen dentro del intervalo normal de
12. PRECAUCIONES Y RELACIÓN CON EFECTOS DE CARCINOGÉNESIS,
MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Los estudios de toxicidad repetida con estradiol, acetato de nomegestrol o su combinación
han indicado efectos estrogénicos y de gestágeno esperados.
Los estudios de toxicidad reproductiva realizados con la combinación han mostrado
fetotoxicidad, lo que es consistente con la exposición al estradiol.
No se realizaron estudios de genotoxicidad ni carcinogenicidad con la combinación. El acetato
de nomegestrol no es genotóxico.
Sin embargo, debe tenerse en mente que los esteroides sexuales pueden promover el
crecimiento de ciertos tumores y tejidos dependientes de hormonas.
13. DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología
Debe tomarse una tableta al día durante 28 días consecutivos. Cada paquete inicia con 24
tabletas blancas de activo, seguidas por 4 tabletas amaril as de placebo. Se inicia el siguiente
paquete inmediatamente después de terminar el paquete previo, sin interrupción en la ingesta
diaria de tableta e independientemente de la presencia o ausencia de sangrados por
deprivación. El sangrado por deprivación inicia regularmente en el día 2-3 después de la toma
de la última tableta blanca y podría no haber terminado antes de iniciar el siguiente paquete.
Vea también "Control del ciclo"
Poblaciones especiales
Insuficiencia renal
Aunque no hay datos disponibles sobre pacientes con insuficiencia renal, es poco probable
que esta afecte la eliminación del acetato de nomegestrol y estradiol.
Insuficiencia hepática
No se han realizado estudios en pacientes con insuficiencia hepática. Debido a que el
metabolismo de las hormonas esteroides podría verse alterado en pacientes con enfermedad
hepática severa, el uso de ZOELY® en estas mujeres no está indicado en tanto los valores de
función hepática no regresen a la normalidad.
Método de administración
Cómo tomar ZOELY®
Las tabletas deben tomarse cada día aproximadamente a la misma hora independientemente
de las comidas. Tome las tabletas con el líquido que sea necesario y en el orden que se indica
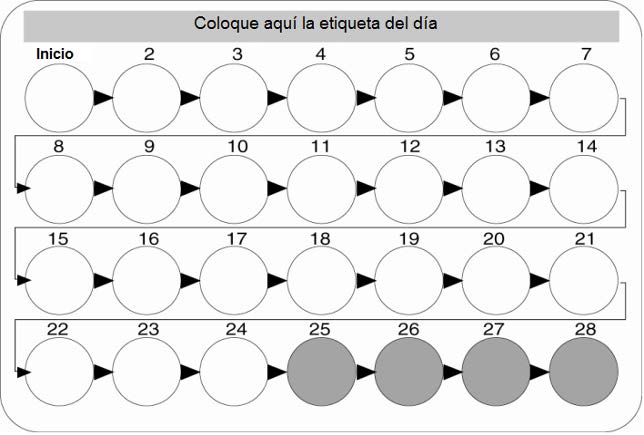
en el blíster. Se incluyen las etiquetas marcadas con los siete días de la semana. La mujer
debe elegir la etiqueta que inicia con el día en que el a comienza a tomar las tabletas y
pegarla en el blíster.
Cómo iniciar ZOELY®
Sin uso precedente de anticonceptivo hormonal (en el mes anterior)
La toma de la tableta tiene que iniciar el día 1 del ciclo natural de la mujer (es decir, el primer
día de su sangrado menstrual). Cuando lo hace de esta forma, no son necesarias medidas
anticonceptivas adicionales. Se puede iniciar los días 2-5, pero debe utilizarse un método de
barrera durante el primer paquete de píldoras hasta que la mujer haya completado 7 días de
ingesta ininterrumpida de la tableta blanca (vea la Imagen 1).
Cambio de un anticonceptivo hormonal combinado (anticonceptivo oral combinado (COC, por
sus siglas en inglés), anil o vaginal o parche transdérmico)
La mujer debe iniciar ZOELY® preferentemente el día después de la última tableta activa (la
última tableta que contiene las substancias activas) de su COC previo, pero a más tardar el
día después del intervalo regular libre de tableta o con tableta de placebo, de su COC previo.
En caso de haber utilizado anil o vaginal o parche transdérmico, la mujer debe empezar a
utilizar ZOELY® preferentemente el día del retiro, pero a más tardar en la fecha programada
para realizar la siguiente aplicación.
Cambio de un método sólo de progestágeno (minipíldora, implante, inyectable) o de un
sistema intrauterino (DIU) medicado con hormonas
La mujer puede cambiar cualquier día de la minipíldora y ZOELY® debe iniciarse el siguiente
día. Un implante o DIU pueden retirarse cualquier día, y ZOELY® debe iniciarse en el día de
su retiro. Cuando el cambio sea desde un inyectable, ZOELY® debe iniciarse en el
programado para realizar la siguiente inyección. En todos estos casos, se debe aconsejar a la
mujer que utilice un método de barrera adicional hasta completar 7 días de ingesta
ininterrumpida de la tableta de activo blanca.
Después de un aborto en el primer trimestre
La mujer puede iniciar de inmediato. Cuando lo haga, no necesita tomar medidas
anticonceptivas adicionales.
Después de un parto o aborto en el segundo trimestre
Debe recomendarse a las mujeres que inicien entre el día 21 y 28 después del parto o aborto
en el segundo trimestre. Cuando inician después de esa fecha, se debe aconsejar a la mujer
que utilice un método de barrera adicional durante los primeros 7 días de ingesta de tableta
de activo blanca. Sin embargo, si ya ha tenido relaciones sexuales, debe descartarse la
posibilidad de embarazo antes de empezar el uso de COC o la mujer tiene que esperar su
primer periodo menstrual.
Para mujeres en lactancia vea la Restricciones de uso durante el embarazo y la lactancia.
Manejo de tabletas olvidadas
Las siguientes recomendaciones se refieren únicamente a las tabletas blancas activas
Si han transcurrido menos de 12 horas desde la hora habitual en que toma su tableta,
entonces se mantiene la confiabilidad de la tableta. Tome la tableta en cuanto se de cuenta
del olvido y tome las siguientes tabletas en el horario habitual.
Si han transcurrido más de 12 horas desde la hora habitual en que toma su tableta, la
confiabilidad de la tableta puede disminuir. El manejo de las tabletas faltantes puede ser
guiado por las siguientes dos reglas básicas:
• Se requieren 7 días de toma ininterrumpida de ‘tableta blanca activo' para lograr una
adecuada supresión del eje ovario – pituitaria – hipotálamo.
• Entre más ‘tabletas blancas activas" dejen de tomarse y entre más cercanas estén las
tabletas a las 4 tabletas amaril as de placebo, mayor será el riesgo de un embarazo.
Recomendación de tableta faltante
Una tableta de activo blanca faltante
No se reduce la protección anticonceptiva. La usuaria debe tomar la última tableta blanca
faltante tan pronto como lo recuerde, aún si esto significa tomar dos tabletas al mismo
tiempo. Después el a continúa tomando las tabletas en la hora habitual. El a no necesita
protección anticonceptiva adicional.
Dos tabletas de activo blancas faltantes
Si la mujer olvidó dos o más tabletas blancas y posteriormente no presenta sangrado por
deprivación mientras toma las tabletas amaril as de placebo, debe considerarse la posibilidad
de un embarazo (vea también ‘Control de ciclo').
Tome la tableta olvidada en cuanto se de cuenta (incluso si esto significa tomar dos tabletas
al mismo tiempo) y tome las tabletas siguientes a la hora habitual. Use precauciones de
anticoncepción adicionales (método de barrera) por los siguientes 7 días. Si ha tenido
relaciones sexuales en la semana anterior al olvido de las tabletas, existe la posibilidad de
estar embarazada. Comuníquelo a su médico inmediatamente.
Tome la tableta olvidada en cuanto se de cuenta (incluso si esto significa tomar dos tabletas
al mismo tiempo) y tome las siguientes tabletas a la hora habitual. Use precauciones de
anticoncepción adicionales (método de barrera) por los siguientes 7 días.
Día 18-24
El riesgo de una menor confiabilidad es mayor debido a la proximidad del intervalo de tabletas
amaril as de placebo. Sin embargo, al ajustar el calendario de ingesta de tabletas, puede
prevenirse la reducción en la protección anticonceptiva. La usuaria debe tomar la última
tableta blanca faltante tan pronto como lo recuerde, aún si esto significa tomar dos tabletas al
Nunca debe tomar más de dos tabletas blancas al mismo tiempo a menos que sea por olvido.
Debe utilizarse un método de barrera hasta que complete 7 días de ingesta ininterrumpida de
tableta blanca. Así, el siguiente paquete debe iniciarse el día después de que se terminen las
tabletas blancas en el paquete en curso, es decir, no deben tomarse tabletas amaril as de
placebo. Es poco probable que la usuaria tenga un sangrado por deprivación hasta que tome
las tabletas amaril as del segundo paquete, pero podría experimentar sangrado periovulatorio
o manchado mientras toma las tabletas blancas.
Nota: si la usuaria no está segura del número o color de las tabletas faltantes y sobre qué
consejo seguir, debe utilizarse un método de barrera hasta completar 7 días de ingesta
ininterrumpida de tableta de activo blanca.
Tabletas amarillas placebo olvidadas
No se reduce la protección anticonceptiva. Las tabletas amaril as de la última fila (4ta) del
blíster pueden ignorarse. Sin embargo, las tabletas faltantes deben desechare de inmediato
para evitar prolongar de forma no intencionada la fase de tabletas de placebo.
Consejo en caso de trastornos gastrointestinales
En caso de trastorno gastrointestinal severo (por ej., vómito o diarrea), podría no completarse
la absorción de las substancias activas y por lo tanto deben tomarse medidas anticonceptivas
Si se presenta vómito en las 3-4 horas siguientes a la ingesta de la tableta blanca, dicha
tableta debe considerarse como faltante. En el caso de una tableta blanca faltante no se
reduce la protección anticonceptiva. Si el vómito se presenta nuevamente el(los) día(s)
siguiente(s), entonces vea "Manejo de tabletas faltantes". Si la mujer no quiere cambiar su
calendario normal de ingesta de tableta, tiene que tomar la(s) tableta(s) blanca(s) adicionales
de otro paquete.
Cómo cambiar periodos o cómo retrasar un periodo
Para retrasar un periodo la mujer debe continuar con otro paquete de ZOELY® sin tomar las
tabletas amaril as del paquete en curso. La extensión puede prolongarse tanto tiempo como
se desee hasta el final de las tabletas blancas en el segundo paquete. La ingesta regular de
ZOELY® se retoma después de tomar las tabletas amaril as de placebo del segundo paquete.
Durante la extensión, la mujer podría experimentar sangrado periovulatorio o manchado.
Para cambiar sus periodos a un día de la semana diferente del que la mujer está habituada
con su esquema actual, puede aconsejársele acortar la fase próxima de tabletas de placebo
por un máximo de 4 días. Entre más corto sea el intervalo, mayor es el riesgo de que no
tenga un sangrado por deprivación y de experimentar sangrado periovulatorio y manchado
durante el paquete siguiente (al igual que cuando retrasa un periodo).
14. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACION O INGESTA
ACCIDENTAL:
Se han utilizado dosis múltiples de hasta cinco veces la dosis diaria de ZOELY® y dosis únicas
de hasta 40 veces la dosis diaria de acetato de nomegestrol sólo en mujeres sin presentarse
alteraciones de seguridad. Con base en la experiencia general con los anticonceptivos orales combinados, los síntomas
que podrían presentarse son: náusea, vómito y, en mujeres jóvenes, sangrado vaginal leve.
No hay antídotos y el resto del tratamiento debería ser sintomático.
15. PRESENTACIONES:
ZOELY® se presenta en caja con 1 o 3 blíster de 28 tabletas (24 tabletas blancas activas y 4
tabletas amaril as placebo)
No todas las presentaciones podrían estar disponibles en el mercado.
16. RECOMENDACIONES PARA EL ALMACENAMIENTO:
Conserve a no más de 30°C en el empaque original y en lugar seco.
17. LEYENDAS DE PROTECCIÓN:
Dosis la que el médico señale. Su venta requiere receta médica. No se deje al alcance de los
niños. No se use en el embarazo ni en la lactancia. Léase instructivo anexo.
Protéjase de la luz
No use ZOELY® después de la fecha de caducidad establecida en el empaque. Esta fecha se
refiere al último día del mes indicado. Este medicamento debe usarse bajo estricto control medico. Los medicamentos no deben ser desechados en las aguas residuales ni en la basura
domestica. Pregunte a su farmacéutico acerca de cómo deshacerse de los medicamentos que
ya no use. Estas medidas ayudarán a proteger el medio ambiente.
18. NOMBRE Y DOMICILIO DEL LABORATORIO:
Schering-Plough, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P. 16090 Deleg. Xochimilco D.F., México.
19. NÚMERO DE REGISTRO DEL MEDICAMENTO:
SmPC Estándar de Organon para ZOELY®
RA 06601 OS S4 (ref 1.3)
Source: http://profesionales.msd.com.mx/static/images/ZOELY_AMPLIO.pdf
Security Challenges Health Security Challenges: Biological Weapons and Pandemic Christian Enemark This article examines two disease-based threats to Australia's security—biological weapons and pandemic influenza—and the national and international dimensions of Australia's response. Overall, the best response is to increase public health capacity because the measures needed to protect people during a naturally-occurring infectious disease outbreak are largely the same as would be required to mitigate a biological attack. The article assesses also that the Biological Weapons Convention should be supported as an emerging instrument of global health, and that the Australian Government needs to improve its published plan for responding to pandemic influenza, especially with regard to vaccines.
This article appeared in a journal published by Elsevier. The attached copy is furnished to the author for internal non-commercial research and education use, including for instruction at the authors institution and sharing with colleagues. Other uses, including reproduction and distribution, or selling or licensing copies, or posting to personal, institutional or third party





