
Cialis ist bekannt für seine lange Wirkdauer von bis zu 36 Stunden. Dadurch unterscheidet es sich deutlich von Viagra. Viele Schweizer vergleichen daher Preise und schauen nach Angeboten unter dem Begriff cialis generika schweiz, da Generika erschwinglicher sind.
Simposiodeneumologia.es
41 Simposio de Neumología
Prólogo Broncodilatación en EPOC Neumología y Atención Primaria. La unión hace la fuerza Therapeutic options in COPD Nuevas formas de dejar de fumar Cáncer de pulmón. Presente y futuro Oxigenoterapia domiciliaria. No sólo oxígeno Buscando la causa de la fibrosis pulmonar idiopática Tratamiento de la hipertensión arterial pulmonar Herpes zóster. Una comorbilidad prevenible en la EPOC New concepts of infection and the lung
En los últimos años asistimos a importantes avances en diferentes campos de la patología respiratoria. Es difícil estar al día en todas las novedades. Reunir a algunas de las personas más relevantes y más directamente implicadas en estos conocimientos favorece una puesta al día que sea de utilidad para aproximar el desarrollo científico a la práctica clínica diaria.
Las novedades en fármacos en EPOC, a la vez que aportan ventajas indudables,
broncodilatadores, cuándo retirar corticoides … Autores que conocen de primera mano estos temas, que han participado directamente en normativas, aportan ideas para clarificar conceptos. En este mismo año, el asma ha merecido una nueva normativa de aplicación en nuestro medio, la guía GEMA, en la que han participado todas las sociedades científicas. Su coordinador resume los puntos más novedosos, facilitando al clínico llevarla a la práctica.
La cooperación entre el ámbito de la atención especializada, y la atención primaria es fundamental en la asistencia práctica al paciente. Además, trabajos llevados a cabo en nuestro país demuestran que la cooperación es exitosa también en investigación. Resulta muy interesante conocer experiencias concretas, que puedan servir para extender esta forma de colaboración.
Tabaquismo, situación del cáncer de pulmón, siguen siendo aspectos fundamentales, y por ello han ocupado un puesto relevante en nuestro 41 simposio. Los autores han aportado datos muy interesantes, aquí recogidos.
Son muchos los pacientes que reciben terapias domiciliarias, destacando la oxigenoterapia. Hay muy interesantes avances tecnológicos, encaminados a facilitar la vida de los usuarios favoreciendo la movilidad. Una normativa reciente actualiza las indicaciones y condiciones de aplicación. Uno de sus autores actualiza la información en este campo.
La fibrosis pulmonar ha merecido recientemente gran atención por la irrupción en el mercado de fármacos antifibróticos . En esta ocasión hemos querido además centrar el foco en las causas. Hay datos sorprendentes acerca de cómo la inhalación de elementos de uso cotidiano puede poner en marcha la reacción inflamatoria pulmonar
que finalmente conduzca a la fibrosis. La aparición en el mercado de fármacos específicos, así como los destinados al tratamiento de la hipertensión pulmonar, están cambiando la evolución de estas dos patologías. Es interesante la visión desde un equipo trasplantador, con la perspectiva de años de experiencia.
La función preventiva de la Medicina está cobrando relevancia día a día. No solo se acumulan datos que consolidan las indicaciones de vacunas establecidas, sino que aparecen evidencias de la importancia de otras infecciones en pacientes con patología respiratoria previa. En esta ocasión se nos aportan los primeros datos sobre la trascendencia del herpes Zóster y la posibilidad de su prevención.
En octubre de 2015 hemos celebrado nuestro 41 Simposio de Neumología. Hemos tenido ocasión de contar con los mejores ponentes para tratar temas de gran interés. Ahora tiene en sus manos el libro que recoge los resúmenes de lo tratado. De nuevo debemos agradecer a GSK su inestimable colaboración para poder acercar los avances en Neumología a la práctica diaria.
Ana Pueyo Bastida
BRONCODILATACIÓN EN EPOC
JL López-Campos (1,2)
1. Unidad Médico-Quirúrgica de Enfermedades Respiratorias. Hospital
Universitario Virgen del Rocío. Instituto de Biomedicina de Sevilla (IBiS). Universidad de Sevilla.
2. CIBER de Enfermedades Respiratorias (CIBERES). Instituto de
Salud Carlos III, Madrid, España.
1. DOBLE BRONCODILATACIÓN EN LA EPOC.
En los últimos años se ha puesto claramente de manifiesto que la
enfermedad pulmonar obstructiva crónica (EPOC) se debe abordar
desde una perspectiva multidimensional que tenga en cuenta las
distintas facetas de la enfermedad de manera conjunta. Según las
diferentes normativas disponibles (1, 2), la mejoría de los síntomas, la
función pulmonar y la disminución del riesgo de agudizaciones
constituyen algunos de los principales pilares que deben guiar la
estrategia de tratamiento farmacológico. En este contexto, la
administración conjunta de dos broncodilatadores de acción
prolongada, denominada doble broncodilatación (3), ha tomado fuerza
en los últimos años como una modalidad terapéutica con resultados clínicos demostrados en diversos aspectos de la enfermedad (4).
En el momento actual, disponemos de un considerable número de
broncodilatadores de acción prolongada, tanto agonistas β2 (LABA), como antimuscarínicos (LAMA),
que nos permiten hacer
combinaciones seleccionando estos fármacos tomados de dos en dos
(figura 1). Esta doble broncodilatación adquiere una especial
importancia desde el momento en que se disponen de dos
broncodilatadores en un solo dispositivo de inhalación, ya que
favorece la cumplimentación, y por tanto la eficacia, a un menor
coste (5)
. En España vamos a tener 4 combinaciones fijas de dos
broncodilatadores que están presentadas en la figura 1.
Según los resultados de los ensayos clínicos disponibles, la doble
broncodilatación ha demostrado mejoría en función pulmonar,
síntomas, calidad de vida y capacidad de ejercicio frente a placebo (6).
Ahora que comenzamos a adquirir experiencia sobre el uso de la
doble terapia broncodilatadora en la EPOC, se nos plantean dos
grades controversias: las diferencias con la broncodilatación simple y
el efecto sobre las agudizaciones
Diferencias frente a la broncodilatación simple.
La medida más habitual de valoración de la mejoría farmacológica de
la obstrucción bronquial es el denominado FEV1 valle (del inglés, trough FEV1) que es el valor que toma en su momento más bajo que en los ensayos clínicos suele ser antes de la primera dosis de la
mañana. La mejoría del FEV1 valle se ha demostrado para las cuatro combinaciones dobles con ganancias medias de entre 70 y 90 mL
para glicopirronio/indacaterol a los 6 meses (7), entre 45 y 85 mL
frente a formoterol para aclidinio/formoterol a los 6 meses (8, 9), de 22
a 112 mL para umeclidinio/vilanterol a los 6 meses (10-12) y 50 a 88
mL para tiotropio/olodaterol a los 12 meses (13). Además del FEV1 valle, los ensayos también evalúan el inicio de acción con diversas
medidas entre 1 y 6 horas tras la dosis, el FEV1 máximo alcanzado tras la inhalación de una dosis (FEV1 pico) y una evaluación de la ganancia funcional durante las 24 horas mediante la denominada
área bajo la curva (en inglés, AUC) habitualmente durante las 24
horas pero en ocasiones también por periodos de 12 horas o menos.
Todas estas medidas nos indican que usar dos broncodilatadores
asociados en un solo inhalador consigue mejorías funcionales relevantes.
Sin embargo, a pesar de la contrastada mejoría funcional de la doble
broncodilatación, la mejoría en síntomas podría considerarse menos
llamativa que la que cabría esperar. Los estudios de
glicopirronio/indacaterol muestran una mejoría en torno a medio
punto del transitional dyspnea index (TDI) cuya relevancia clínica está
en un punto de la escala frente a placebo con una situación similar
para la mayoría de las combinaciones dobles (7, 13-15). Discusión
aparte sobre si esta diferencia es o no clínicamente relevante,
analizando los datos parece evidente que existe una variabilidad en la
respuesta a la broncodilatación doble. Por tanto, es misión del clínico
saber evaluar las circunstancias clínicas que deben guiar la aplicación de la broncodilatación doble.
Doble broncodilatación y agudizaciones
El estudio de la doble broncodilatación en agudizaciones debe ser
analizado con cautela. Estos trabajos no se diseñaron para ver
agudizaciones, tienen insuficiente tiempo de seguimiento, además la
definición de exacerbacion, y su gravedad no siempre son
superponibles y en algunos estudios no se recogieron de manera exhaustiva.
Los primeros resultados se comunicaron con el estudio SPARK (16) en
el que indacaterol/glicopirronio redujo significativamente la tasa de
todas las exacerbaciones en un 15% comparado con glicopirronio y
en un 14% comparado con tiotropio. Además esta doble
broncodilatación redujo la tasa de exacerbaciones moderadas-graves
en un 12% frente a glicopirronio y en un 10% frente a tiotropio (este
último no significativo). Curiosamente, al dividir por gravedad las
agudizaciones, la eficacia en la reducción de la tasa de agudizaciones
leves se mantenía de manera similar a la cohorte total, con una
disminución del 15% comparando con glicopirronio y del 14%
comparada con tiotropio. Sin embargo, la tasa de agudizaciones
graves fue baja y no alcanzó significación estadística. Por tanto, los
resultados parecían indicar que estas diferencias en agudizaciones
eran principalmente en las leves. Actualmente, están en desarrollo
nuevos estudios para comparar la eficacia en la reducción de
agudizaciones frente a la terapia combinada de un LABA con un
corticoide inhalado (17).
Los dos estudios disponibles con aclidinio/formoterol están hechos a 6
meses y en el análisis agregado de los datos encuentra una reducción
de las agudizaciones frente a placebo, pero no frente a los
monocomponentes (15). En la combinación de tiotropio/olodaterol dos
ensayos a un año encuentran una reducción del tiempo a la primera
agudización significativa para la comparación frente a olodaterol, pero
no frente a tiotropio(13). Finalmente, umeclidinio/vilanterol en
estudios a 6 meses consigue una reducción de agudizaciones que no
se mantiene frente a los monocomponentes, salvo por un estudio
comparativo directo contra tiotropio que observan un reducción con una hazard ratio de 0,5 (11).
2. EL FUTURO: LA BRONCODILATACIÓN DUAL.
Lo que denominamos broncodilatación doble es administrar dos
moléculas distintas con sus propias características farmacológicas y
que, administradas en el mismo inhalador, sirven para ejercer la
misma acción farmacológica. Un broncodilatador dual sería aquel que
tuviera la capacidad de hacer el efecto de dos con una sola molécula
(figura 2). Estos broncodilatadores duales están representados por
los denominados MABA (muscarinic antagonist and β2 agonist). Los MABA son una nueva familia de moléculas que tienen una verdadera
actividad dual; por un lado inhiben los receptores muscarínicos y,
además, la misma molécula es agonista de los receptores β2 adrenérgicos (18).
La utilización de un MABA tiene ventajas evidentes, entre las que
figuran la acción sobre ambos receptores, la probable mejoría de la
adherencia, la acción sobre ambos receptores en una determinada
proporción con un solo perfil farmacocinético y una posible acción
potenciada en capacidad broncodilatadora. Por otro lado, es necesario
estudiar su efecto sobre la tolerancia de los receptores y no se puede
elegir si queremos que actúe preferentemente sobre una vía autonómica u otra.
Actualmente, existen diversos MABAs en desarrollo(19). El más
avanzado en su desarrollo clínico es el batefentrol (GSK961081). Esta
molécula tiene ya ensayos que nos indican su excelente capacidad
broncodilatadora con mejorías de hasta 277 mL en el FEV1 valle frente a placeo con administraciones de una sola toma al día (20).
Adicionalmente, en los estudios disponibles no se observa una clara
relación entre los niveles plasmáticos de batefenterol y parámetros de seguridad cardiaca relacionados (21).
3. NUEVAS ESTRATEGIAS DE BRONCODILATACIÓN DUAL.
Las fosfodiesterasas (PDE) son una extensa familia de 11 subtipos de
enzimas que modulan las concentraciones intracelulares de los
nucleótidos cíclicos que a su vez participan en diversas funciones
celulares. En el contexto de las enfermedades respiratorias, un
aumento de AMP cíclico se asocia con la relajación del músculo liso de las vías respiratorias y un espectro de acciones anti-inflamatorias (22).
Hasta el momento, la isoenzima PDE4 se identificó como un objetivo
terapéutico importante en enfermedades respiratorias porque es la
isoenzima predominante en la mayoría de las células inflamatorias
implicadas en la patogénesis de la EPOC y del asma. Sin embargo, la
PDE4 también está presente junto a la isoenzima PDE3 en el músculo
liso de las vías respiratorias. De hecho, la isoenzima PDE3 se
considera predominante en el músculo liso de las vías respiratorias y
la inhibición de esta enzima conduce a la relajación del músculo liso
con efecto broncodilatador (23).
Por tanto, una inhibición de la PDE4 y la PDE3 tendría efectos
antiinflamatorios y broncodilatadores. Actualmente, se están
desarrollando inhibidores duales de ambas isoenzimas entre los que
figuran compuestos como la pumafentrina o la zardaverina (24) que no
han llegado a la comercialización por problemas durante su
desarrollo. El compuesto que está más avanzado en el desarrollo es el
denominado RPL554. Este compuesto se ha evaluado en cuatro
estudios exploratorios, de donde se desprende que RPL554 inhalado
es un fármaco eficaz y bien tolerado, con propiedades
broncodilatadora, broncoprotectora y antiinflamatoria (25). Su principal
limitación es la corta duración de su acción. Por este motivo se está
explorando su asociación con broncodilatadores de acción prolongada
como el glicopirronio(26). Estudios futuros establecerán todo el
potencial de este nuevo fármaco para el tratamiento de los pacientes con EPOC o asma.
1. Miravitlles M, Soler-Cataluna JJ, Calle M, Molina J, Almagro P,
Quintano JA, et al. Spanish guideline for COPD (GesEPOC).
Update 2014.
Arch Bronconeumol 2014; 50 Suppl 1: 1-16.
2. Vestbo J, Hurd SS, Agusti AG, Jones PW, Vogelmeier C, Anzueto A,
et al. Global strategy for the diagnosis, management, and
prevention of chronic obstructive pulmonary disease: GOLD
executive summary.
Am J Respir Crit Care Med 2013; 187: 347-
3. Lopez-Campos JL, Abad-Arranz M, Calero-Acuna C. Double or Dual
Bronchodilation: Defining the Correct Term.
Arch Bronconeumol
4. Prakash A, Babu KS, Morjaria JB. Profile of inhaled glycopyrronium
bromide as monotherapy and in fixed-dose combination with
indacaterol maleate for the treatment of COPD.
Int J Chron
Obstruct Pulmon Dis 2015; 10: 111-123.
5. Price D, Keininger D, Costa-Scharplatz M, Mezzi K, Dimova M,
Asukai Y, et al. Cost-effectiveness of the LABA/LAMA dual
bronchodilator indacaterol/glycopyrronium in a Swedish
healthcare setting.
Respir Med 2014; 108: 1786-1793.
6. Ulrik CS. Clinical benefit of fixed-dose dual bronchodilation with
glycopyrronium and indacaterol once daily in patients with
chronic obstructive pulmonary disease: a systematic review.
Int
J Chron Obstruct Pulmon Dis 2014; 9: 331-338.
7. Bateman ED, Ferguson GT, Barnes N, Gallagher N, Green Y, Henley
M, et al. Dual bronchodilation with QVA149 versus single
bronchodilator therapy: the SHINE study.
Eur Respir J 2013;
8. Singh D, Jones PW, Bateman ED, Korn S, Serra C, Molins E, et al.
Efficacy and safety of aclidinium bromide/formoterol fumarate
fixed-dose combinations compared with individual components
and placebo in patients with COPD (ACLIFORM-COPD): a
multicentre, randomised study.
BMC Pulm Med 2014; 14: 178.
9. D'Urzo AD, Rennard SI, Kerwin EM, Mergel V, Leselbaum AR,
Caracta CF, et al. Efficacy and safety of fixed-dose combinations
of aclidinium bromide/formoterol fumarate: the 24-week,
randomized, placebo-controlled AUGMENT COPD study.
Respir
Res 2014; 15: 123.
10. Donohue JF, Maleki-Yazdi MR, Kilbride S, Mehta R, Kalberg C,
umeclidinium/vilanterol 62.5/25 mcg in COPD.
Respir Med
2013; 107: 1538-1546.
11. Maleki-Yazdi MR, Kaelin T, Richard N, Zvarich M, Church A.
Efficacy and safety of umeclidinium/vilanterol 62.5/25 mcg and
tiotropium 18 mcg in chronic obstructive pulmonary disease: results
of a 24-week, randomized, controlled trial.
Respir Med 2014;
12. Decramer M, Anzueto A, Kerwin E, Kaelin T, Richard N, Crater G,
et al. Efficacy and safety of umeclidinium plus vilanterol versus
tiotropium, vilanterol, or umeclidinium monotherapies over 24
weeks in patients with chronic obstructive pulmonary disease:
results from two multicentre, blinded, randomised controlled
trials.
Lancet Respir Med 2014; 2: 472-486.
13. Buhl R, Maltais F, Abrahams R, Bjermer L, Derom E, Ferguson G,
et al. Tiotropium and olodaterol fixed-dose combination versus
mono-components in COPD (GOLD 2-4).
Eur Respir J 2015; 45:
14. Celli B, Crater G, Kilbride S, Mehta R, Tabberer M, Kalberg C, et
al. Once-daily umeclidinium/vilanterol 125/25 mcg in COPD: a
randomized, controlled study.
Chest 2014; 145: 981-991.
15. Bateman ED, Chapman KR, Singh D, D'Urzo AD, Molins E,
Leselbaum A, et al. Aclidinium bromide and formoterol fumarate
as a fixed-dose combination in COPD: pooled analysis of
symptoms and exacerbations from two six-month, multicentre,
randomised studies (ACLIFORM and AUGMENT).
Respir Res
16. Wedzicha JA, Decramer M, Ficker JH, Niewoehner DE, Sandstrom
T, Taylor AF, et al. Analysis of chronic obstructive pulmonary
disease exacerbations with the dual bronchodilator QVA149
compared with glycopyrronium and tiotropium (SPARK): a
randomised, double-blind, parallel-group study.
Lancet Respir
Med 2013; 1: 199-209.
17. Zhong N, Wang C, Zhou X, Zhang N, Humphries M, Wang L, et al.
salmeterol/fluticasone combination in patients with COPD.
Int J
Chron Obstruct Pulmon Dis 2015; 10: 1015-1026.
18. Hughes AD, McNamara A, Steinfeld T. Multivalent dual
pharmacology muscarinic antagonist and beta(2) agonist
(MABA) molecules for the treatment of COPD.
Prog Med Chem
2012; 51: 71-95.
19. Page C, Cazzola M. Bifunctional drugs for the treatment of asthma
and chronic obstructive pulmonary disease.
Eur Respir J 2014;
20. Wielders PL, Ludwig-Sengpiel A, Locantore N, Baggen S, Chan R,
Riley JH. A new class of bronchodilator improves lung function
in COPD: a trial with GSK961081.
Eur Respir J 2013; 42: 972-
21. Ambery CL, Wielders P, Ludwig-Sengpiel A, Chan R, Riley JH.
Population Pharmacokinetics and Pharmacodynamics of
GSK961081 (Batefenterol), a Muscarinic Antagonist and beta-
Agonist, in Moderate-to-Severe COPD Patients: Substudy of a
Randomized Trial.
Drugs R D 2015.
22. Halpin DM. ABCD of the phosphodiesterase family: interaction
and differential activity in COPD.
Int J Chron Obstruct Pulmon
Dis 2008; 3: 543-561.
23. Schudt C, Tenor H, Hatzelmann A. PDE isoenzymes as targets for
anti-asthma drugs.
Eur Respir J 1995; 8: 1179-1183.
24. Abbott-Banner KH, Page CP. Dual PDE3/4 and PDE4 inhibitors:
novel treatments for COPD and other inflammatory airway
diseases.
Basic Clin Pharmacol Toxicol 2014; 114: 365-376.
25. Franciosi LG, Diamant Z, Banner KH, Zuiker R, Morelli N,
Kamerling IM, et al. Efficacy and safety of RPL554, a dual PDE3
and PDE4 inhibitor, in healthy volunteers and in patients with
asthma or chronic obstructive pulmonary disease: findings from
four clinical trials.
Lancet Respir Med 2013; 1: 714-727.
26. Calzetta L, Cazzola M, Page CP, Rogliani P, Facciolo F, Matera MG.
Pharmacological characterization of the interaction between the
dual phosphodiesterase (PDE) 3 / 4 inhibitor RPL554 and
glycopyrronium on human isolated bronchi and small airways.
Pulm Pharmacol Ther 2015; 32: 15-23.
Figura 1. Combinaciones de dos broncodilatadores para el tratamiento de la EPOC
Figura 2. Diferencias entre la administración de fármacos dobles y duales.
NEUMOLOGÍA Y ATENCIÓN PRIMARIA: LA UNIÓN HACE LA FUERZA
Juan Luis García Rivero
Hospital Universitario Marques de Valdecilla. Neumólogo en el
Hospital de Laredo. Presidente de la Asociación cántabra de Investigación en aparato respiratorio (ACINAR) desde 2010
La investigación es imprescindible en todos los ámbitos asistenciales
y para todos los profesionales sanitarios, ya que la práctica clínica, la
investigación y la docencia forman un conjunto que define el trabajo
de calidad.1,2 No obstante, hasta comienzos de la década de los
ochenta, la investigación en Atención Primaria (AP) era anecdótica:
entre 1974 y 1983, menos del 1% de los artículos médicos publicados
estaban relacionados con AP.3 A partir de ese momento aumenta
hasta alcanzar el 4,1% de los artículos recogidos en el IME en 1994,4
debido a la reforma de la AP y la creación de la especialidad de
Medicina de Familia y Comunitaria (MFyC).5 A este período de
crecimiento le sigue otro de estancamiento, en el que nos encontramos en la actualidad.6
En general, aunque ha aumentado mucho en los últimos 20 años, la
investigación en AP puede considerarse aún escasa.7 Respecto a la
calidad de la investigación en AP, se ha dicho que es cuestionable y
mejorable, con discusiones pobres, fallos de diseño, estudios en su
mayoría descriptivos, con encuestas no validadas, realizados en
poblaciones demandantes, con muestras pequeñas, con pocos
trabajos multicéntricos, etc.8-10 Son pocos los estudios multicéntricos
y las líneas de investigación que se mantienen, ya que la mayoría de
las publicaciones son aportaciones esporádicas y sólo un 4% de los
autores publica con cierta asiduidad (más de 5 publicaciones en 10 años).11
En definitiva, aunque se investiga más que antes, la calidad permanece igual.
Aten Primaria. 2005;36(8):415-23
De acuerdo con el estudio realizado por Fernández de Sanmamed et
al.5 en médicos catalanes, el perfil habitual del investigador en AP es
el de un médico de familia vía MIR, de 25-35 años, que trabaja en un centro docente y urbano y cuenta con recursos y apoyo metodológico.
A esto hay que unirle el escaso interés por realizar investigación
sobre temas clínicos.12
Un problema muy frecuente en AP es poder llegar al tamaño muestral
calculado de antemano en el período de tiempo planteado para llevar a cabo el ensayo clínico. La imposibilidad de seleccionar el número
requerido de pacientes reduce la potencia estadística para probar la
hipótesis, prolonga la duración del estudio, consume los escasos
recursos disponibles, amenaza la validez de los resultados de la investigación y hace más probables las violaciones éticas del estudio.
Cuando se pregunta a los médicos de atención primaria por las
dificultades para hacer estudios, las razones más frecuentes son, en
orden decreciente, la presión asistencial, la escasez de tiempo, las
deficiencias estructurales, la ausencia de líneas de investigación
multicéntricas y la falta de incentivación, preparación y motivación.
Sin embargo, a estos deberían sumarse otros como protocolos complejos, enfermedades infrecuentes, uso de pruebas no cotidianas,
no aceptación o baja aceptación del protocolo ya escrito, competencia
con otros estudios sobre la misma enfermedad y falta de interés en la
investigación. La falta de comunicación y coordinación aparece como
otro de los motivos principales en la selección de pacientes en estudios multicéntricos.
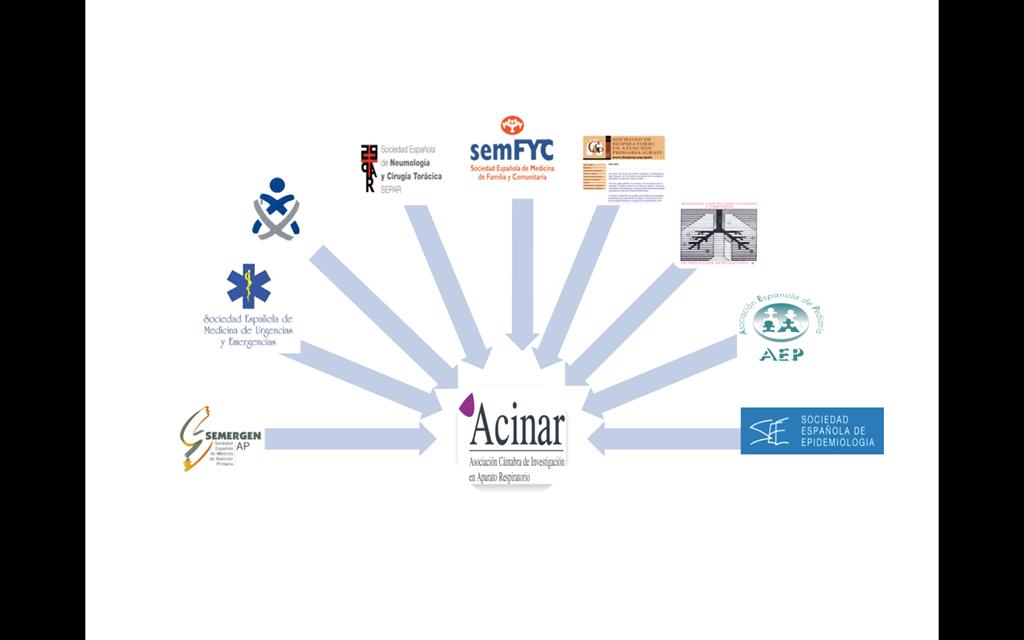
En Cantabria, como en el resto de CCAA de nuestro país, las
sociedades científicas tienden a ser unidisciplinares. Así SEPAR y
SOCALPAR representan a Neumólogos, Cirujanos Torácicos y
Enfermería de Neumología. SEMERGEN, SEMFYC, SEMG y GRAP, lo
hacen con la Atención Primaria. Enfermería tiene sus propias
sociedades, y Epidemiología está representada en la Sociedad española de epidemiología.
Con el objetivo de poner en marcha un grupo de trabajo
multidisciplinar que ayudase a sus miembros a formarse y a realizar
estudios de investigación, nace ACINAR, la asociación cántabra de
investigación en aparato respiratorio. La primera reunión tuvo lugar
en octubre de 2012 en el parador de Limpias, a la cual asistieron 12
médicos de atención primaria y un Neumólogo. Un mes más tarde se
incorporó un epidemiólogo de la Universidad de Cantabria. El 13 de
diciembre del 2012 se constituyen los estatutos de la sociedad,
depositándose y aceptándose por la Consejería de Presidencia del Gobierno de Cantabria.
Desde entonces se han puesto en marcha varias líneas de
investigación, básicamente centradas en la patología de la vía aérea.
Actualmente son 7 los proyectos en marcha, uno de ellos en
colaboración con la Universidad de Elche sobre la "variación de la
flora bacteriana y fúngica en pacientes con EPOC agudizado y tras su
estabilización:
caracterización
La Sociedad cuenta con 67 miembros, el 90% de ellos pertenecientes
a la Atención Primaria.
Se han presentado más de 50 comunicaciones a congresos, incluido
el reciente congreso de la European Respiratory Society que ha tenido lugar en Amsterdam, donde se han presentado 3 comunicaciones.
Ha sido aceptado recientemente el primer manuscrito de la sociedad,
en la revista Archivos de Bronconeumología, y se han enviado dos
más, uno a BMC Pulmonary Medicine y otro a Medicina Clínica, pendientes de revisión.
Jornadas de la sociedad:
I Jornadas de ACINAR: 22 y 23 de noviembre de 2013.
II Jornadas de ACINAR: 26 y 27 de septiembre de 2014.
III Jornadas de ACINAR: 26 y 27 de febrero de 2016.
Seminarios de formación a otros profesionales sanitarios:
Seminario atención global a la EPOC: Santander, 25 abril de
Seminario de actualización en Neumología: Santander, 9 y 10
de octubre de 2015. 3)
Seminario de actualización en Neumología: Bilbao, 11 y 12 de
noviembre de 2015. 4)
Seminario de actualización en Neumología: Pamplona, 29 y 30
de enero de 2015.
Financiación para investigación:
Premio proyecto de investigación congreso SOCALPAR 2013
Premio primer póster exposición congreso SEMERGEN
20.000€ dotación estudio "asma no controlado en Cantabria".
Estudio "EPOXILO": 4.000 €
1.500 € para "open access" del estudio sobre la base de datos
de EPOC en OMI 6)
1.500 € para "open access" para el estudio sobre variabilidad
de la eosinofilia en sangre periférica en pacientes con EPOC a lo largo del tiempo.

Pedrera Carbonell V, Gil Guillén V, Orozco Beltrán D. Unidades
de investigación y docencia de apoyo a la gestión en atención primaria. Aten Primaria. 2003;32:361-5. 2.
Gil VF, Orozco A, Quirce F, Merino J. La epidemiología clínica y
la medicina de familia y comunitaria [editorial]. Aten Primaria. 1995;15:209-10.
Jiménez Villa J, Carré Llopis MC, Argimón Pallás JM. Tipos de
estudios publicados en la revista Atención Primaria (1984- 1990). Aten Primaria. 1993;12:23-30. 4.
Marset Campos P, Sáez Gómez JM, Sánchez Moreno A, Ramos
García E, Sánchez Estévez V, González Díaz M. Perspectiva de la atención primaria española a partir del análisis bibliométrico de su producción científica (1971-1994). Aten Primaria. 1997;19:389-94.
Fernández de Sanmamed MJ, De la Fuente JA, Mercader J,
Borrell C, Martín C, Birulés M, Marcos L. Factores relacionados con la actividad investigadora de los médicos de atención primaria. Aten Primaria. 1997;19:283-9. 6.
Álvarez J. La investigación en atención primaria lejos de su
despegue. Rev Esp Ecom Salud. 2003;2:142-4. 7.
Fernández Fernández I. ¿Investigación en atención primaria?
[editorial]. Aten Primaria. 2003;31:281-4. 8.
Gómez de la Cámara A. Aspectos de la investigación sobre
atención primaria. Aten Primaria. 1993;11:370-3.
López Fernández LA, Martínez Millán JI, García Calvente MM,
March Cerdá JC. La investigación en atención primaria en España. Rev Salud Pública. 1993;3:135-54. 10.
Jiménez Villa J, Carré Llopis MC, Argimón Pallás JM.
Información sobre los aspectos metodológicos en los artículos de la revista Atención Primaria. Aten Primaria. 1994;14: 1113-6.
Aleixandre R, Porcel A, Agulló A, Marset S, Abad F. Diez años
de la revista Atención Primaria (1984-1993): análisis bibliográfico y
temático. Aten Primaria. 1998;17:225-30.
Mant D, Del Mar C, Glasziou P, Knottnerus A, Wallace P, Van
Weel C. The state of primary-care research. Lancet. 2004;364:1004-6.
THERAPEUTIC OPTIONS IN COPD
Antonio Anzueto, MD
Professor of Medicine at The University of Texas Health Science
Center at San Antonio. Medical Director of the Pulmonary Function
Laboratory at the University Hospital in San Antonio
We will discuss what other therapeutic option we have for patients
with severe COPD. ICS combined with a LABA are more effective
than the individual components in improving lung function and health
status and reducing exacerbations in these patients. Although large
prospective clinical trial failed to demonstrate a statistically significant
effect of combination ICS+LABA therapy on mortality, subsequent
meta-analysis found that combination therapy may reduce mortality
with a number needed to treat (NNT) of 36. A recent observational
database study suggests that among older adults with COPD and
either a co-diagnosis of asthma or a concomitant treatment with
LAMA newly prescribed LABA-ICS combination therapy, compared
with newly prescribed LABAs alone, was associated with a
significantly lower risk of the composite outcome of death or COPD
hospitalization. However, despite a careful propensity-based matching
process, residual confounding could not be excluded. Most studies
that found a beneficial effect of ICS+LABA fixed dose combinations
(FDC) over LABA alone (i.e., showing an effect of the ICS component
of FDCs) in terms of exacerbation rate recruited patients with a history of exacerbations (at least one in the previous year).
Can we withdraw ICS ? Results from withdrawal studies provide
equivocal results, which may relate in part to methodological issues.
One study (COPE) showed that withdrawal of ICS may lead to
exacerbations in some patients (half of whom were on LABA treatment, and none on LAMA, which were not available at this time)
In the COSMIC trial, where all patients were on salmeterol during the study duration (and none on LAMA), ICS withdrawal resulted in an
increase in mild but not moderate to severe exacerbations. In the
more recent WISDOM study, in whom all patients received
maintenance therapy with LABA and LAMA, no increase in
exacerbations was observed following tapered ICS withdrawal (Figure
1) . In the latter study, as well as in the COSMIC trial, ICS withdrawal
was followed by a modest loss of lung function (4.1% FEV1 in
COSMIC, 40 ml in WISDOM) (Figure 2). The COSMIC trial also found
an increase in symptoms following ICS withdrawal, which was not
evidenced in WISDOM. Finally, a very recent study further supports
that ICS discontinuation after 30-month in COPD can worsen lung function decline, AHR and QOL during 5-year follow-up.
There is some uncertainty regarding possible systemic side-effects
associated with long-term treatment with ICS in COPD patients.
There is clear evidence of an ICS-related increase in the risk of
pneumonia. Patients in whom FDCs have been shown to provide a
greater reduction in exacerbation rate than LABAs alone are those
with a history of exacerbations (at least one per year). Considering
that long-acting bronchodilators alone also have beneficial effects in
terms of exacerbation rate and given the evidence mentioned above,
the use of FDCs that include ICS should be restricted to patients with
bronchodilator therapy. However the patients for whom ICS/LABA
benefit the most may be those who also have the greatest absolute
risk of pneumonia . Further research is needed to identify patients
who benefit greatest/least, in order to further enhance the benefit-
risk profile. As mentioned above some biomarkers, e.g. sputum or
blood eosinophils, might be of interest in this respect. In a recent
publication that was a secondary analysis of the fluticasone fumarte /
vilanterol registration trials demonstrated that patients with elevated baseline serum eosinophils had increased reduction of COPD
exacerbations inpatients that received ICS + LABA combination as
compared with LABA alone (Figure 3). Furthermore, this study also
showed that patient with low serum eosinophils and received ICS were an increased risk to develop pneumonia
Randomized clinical trials show that the addition of ICS/LABA to LAMA
improves lung function, patient reported outcomes and exacerbation
rates. RCT demonstrate benefit of adding to ICS/LABA a LAMA
showed a reduced exacerbation rate. These studies were conducted in
patients with severe or very severe disease and increased risk for exacerbation.
Another group of COPD patient that will benefit of ICS are those with
the Asthma/COPD overlap syndrome. In these patients with significant asthma history ICS are part of their therapy.
Therefore, there is a role for using ICS in patients with COPD, further
studies will help us to characterize the patient populations that
benefit the most from this therapy.
References:
Aaron SD, Vandemheen KL, Fergusson D, Maltais F, Bourbeau J,
Goldstein R, Balter M, O'Donnell D, McIvor A, Sharma S, Bishop G,
Anthony J, Cowie R, Field S, Hirsch A, Hernandez P, Rivington R, Road
J, Hoffstein V, Hodder R, Marciniuk D, McCormack D, Fox G, Cox G,
Prins HB, Ford G, Bleskie D, Doucette S, Mayers I, Chapman K, Zamel
N, FitzGerald M, Canadian Thoracic Society/Canadian Respiratory
Clinical Research C. Tiotropium in combination with placebo,
salmeterol, or fluticasone-salmeterol for treatment of chronic
obstructive pulmonary disease: a randomized trial. Ann Intern Med 2007; 146: 545-55.
Frith PA, Thompson PJ, Ratnavadivel R, Chang CL, Bremner P, Day P,
Frenzel C, Kurstjens N; Glisten Study Group. Glycopyrronium once-
daily significantly improves lung function and health status when
combined with salmeterol/fluticasone in patients with COPD: the
GLISTEN study, a randomised controlled trial. Thorax. 2015 Jun;70(6):519-27.
Siler TM, Kerwin E, Sousa AR, Donald A, Ali R, Church A. Efficacy and
safety of umeclidinium added to fluticasone furoate/vilanterol in
chronic obstructive pulmonary disease: Results of two randomized studies. Respir Med. 2015 Sep;109(9):1155-1163.
Wedzicha JA, Singh D, Vestbo J, Paggiaro PL, Jones PW, Bonnet-
Gonod F, Cohuet G, Corradi M, Vezzoli S, Petruzzelli S, Agusti A; FORWARD
2014;108:1153-62.
Singh SD, Brooks J, Hagan G, Cahn A, O'Connor B. ‘Triple' therapy
with salmeterol/fluticasone propionate and tiotropium bromide versus
individual components in moderate to severe COPD. Thorax. 2008;63:592-8.
Hanania NA, Crater GD, Morris AN, et al. Benefits of adding
fluticasone propionate/salmeterol to tiotropium in moderate to severe COPD. Respir Med 2012;106:91–101.
Jung KS, Park HY, Park SY, et al. Comparison of tiotropium plus
fluticasone propionate/salmeterol with tiotropium in COPD: a randomized controlled study. Respir Med 2012;106:382–9.
Welte T, Miravitlles M, Hernandez P, et al. Efficacy and tolerability of
budesonide/ formoterol added to tiotropium in patients with chronic
obstructive pulmonary disease. Am J Respir Crit Care Med
2009;180:741–50.
Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone
propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775-89
van der Valk P, Monninkhof E, van der Palen J, Zielhuis G, van
Herwaarden C. Effect of discontinuation of inhaled corticosteroids in patients with chronic obstructive
pulmonary disease: the COPE study. Am J Respir Crit Care Med 2002;166:1358-63
Nannini LJ, Cates CJ, Lasserson TJ, Poole P. Combined corticosteroid
and long-acting beta-agonist in one inhaler versus placebo for chronic
obstructive pulmonary disease.
Cochrane Database of Systematic Reviews 2007;Issue 4. Art. No.: CD003794.
NUEVAS FORMAS DE DEJAR DE FUMAR
José Ignacio de Granda–Orive,
Carlos A. Jiménez–Ruiz,
Segismundo Solano-Reina
Actualmente se define el tabaquismo como una enfermedad crónica y
recidivante, de naturaleza adictiva, que se inicia en el 80% de los
casos antes de los 18 años, con una prevalencia del 24%(1) y que
ocasiona la muerte prematura (acorta la vida en 5-10 años) en más
del 50% de los fumadores, afectando al sistema respiratorio y
cardiovascular, pudiendo originar diversas neoplasias en el
organismo. El consumo de tabaco constituye uno de los principales
problemas de salud pública en todo el mundo, siendo responsable de
cerca de 6 millones de fallecimientos de personas al año(2). Dejar de
fumar supone una ardua lucha para vencer la adicción. En la
actualidad disponemos de elementos terapéuticos para tratar a los
fumadores que acuden a nuestra consulta en demanda de ayuda para
el abandono. Numerosos estudios han demostrado científicamente la
eficacia de estos tratamientos así como su excelente relación
coste/efectividad. Desgraciadamente, la evidencia científica nos indica
que con el arsenal terapéutico disponible en la actualidad las tasas de
fracaso se elevan hasta el 50% en los mejores casos(3). Es por ello
que estamos en la necesidad de buscar nuevos tratamientos que consigan mejorar las tasas de abstinencia al año.
Reducción hasta dejarlo
Hace un par de años el Dr. JR Hughes(4), basándose en su experiencia
y en la evidencia acumulada hasta ese momento para ayudar a dejar
de fumar, publicaba un algoritmo de cómo creía él que debería ser el
árbol de decisión para conseguir la abstinencia del tabaco. En él, y
como novedades principales, incluía la combinación de terapia
sustitutiva y la vareniclina como terapia de primera línea para dejar
de fumar (desplazando al bupropion y a la terapia sustitutiva no
combinada a una segunda línea de tratamiento), entre las opciones
de formato de tratamiento añadía como efectivas la terapia telefónica
y el tratamiento por Internet a las ya conocidas terapias individuales
y en grupo y, sobre todo, colocaba en la misma altura terapéutica a la
cesación brusca del consumo y a la reducción paulatina hasta dejarlo
como igualmente efectivas. Ya una previa revisión Cochrane nos
concluía que reducir el número de cigarrillos antes del día "D" y dejar
de fumar de forma abrupta, sin previa reducción, consigue tasas de
abstinencia comparables, por lo que habría que ofrecer a los
fumadores ambas posibilidades para dejar de fumar(5). En un trabajo
reciente, Schauer et al.(6) por el contrario relacionaba la reducción
hasta dejarlo con peores resultados en cuanto abstinencia, pero
comentaba que reducir se asociaba a ser mujer, ser de raza negra,
ser fumador esporádico y utilizar asesoramiento y medicación, pero
expresaba la necesidad de establecer adecuadamente a quiénes y
cómo puede favorecer la reducción gradual siendo una estrategia
para la abstinencia a analizar en profundidad.
Vareniclina
En el momento actual no existe ninguna duda de la efectividad y
coste/efectividad de la vareniclina (VRN) para ayudar a dejar de
fumar(7). Enlazando con el epígrafe anterior Ebbert et al.(8) en un
trabajo multinacional, aleatorizado, doble ciego y controlado con
placebo valoro la eficacia y seguridad de VRN para aumentar las tasas
de abstinencia tabáquica en un programa de reducción hasta dejarlo
en fumadores que no querían dejar de fumar o no se consideraban
capaces de hacerlo, pero que sí consentían reducir y hacer un intento
de dejarlo a los 3 meses. Los autores encontraron que el grupo VRN
presentó unas más altas tasas de abstinencia continua entre
las semanas 15 y la 24 al compararlo con placebo (VRN 32,1% frente
a 6,9% del grupo placebo (RR), 4,6 [95% IC, 3,5-6,1]). Asimismo el
grupo VRN presento unas más altas tasas de abstinencia continua al
compararlas con el grupo placebo entre las semanas 21 y 24 (VRN
37,8% frente al 12,5% del grupo placebo, RR, 3.0 [95% IC, 2,4-3,7])
y entre las semanas 21 y la 52 (VRN 27,0% frente al 9,9% para el
grupo placebo, RR, 2,7 [95% IC, 2,1-3,5]). Eventos adversos serios
se produjeron en el 3,7% del grupo VRN y en el 2,2% del grupo
placeo (P = 0,07).
Por otra parte, se ha intentado comprobar si aumentar la dosis de
VRN consigue mejores resultados de abstinencia. Sobre este tema,
hasta dónde sabemos, son conocidos dos trabajos, uno de ellos
positivo(9), es decir, los autores concluyen que aumentar la dosis de
VRN en fumadores que no responden al tratamiento estándar y que
no presentaban con dichas dosis efectos adversos consiguieron
mayores tasas de abstinencia. El otro estudio, por el contrario, fue
negativo, pues no se encontraron superiores tasas de abstinencia al
aumentar las dosis de VRN(10). En un trabajo reciente se ha podido
comprobar como la combinación de VRN con terapia sustitutiva
(parches de nicotina) consiguió mejores resultados de abstinencia que la VRN en terapia única(11).
Es conocido que la N-acetil-cisteína (NAC) restaura la señal usual del
glutamato a nivel cerebral, por ello McClure et al.(12) quisieron
demostrar la viabilidad y seguridad de co-administrar NAC y VRN en
sujetos con dependencia por la nicotina, aunque en un escaso
número de sujetos. Los pacientes recibieron durante 4 semanas
1.200 mg de NAC y 1 mg cada 12 hs de VRN y se les preguntó
semanalmente por efectos secundarios, consumo de tabaco, craving y
por síntomas del síndrome de abstinencia. Los autores encontraron
un total de 40 efectos adversos siendo el 88% de ellos leves, con una
excelente adherencia al tratamiento (98%) observando una reducción
en el número de cigarrillos consumidos por día, pero con una abstinencia puntual baja.
Se ha involucrado al ácido gamma amino-butírico (GABA) y al
glutamato en los procesos neuronales centrales de recompensa y su
importancia en la adicción por la nicotina. Es conocido que el efecto
principal de la VRN es como agonista parcial de los receptores
alfa4beta2 de acetil-colina pero recientemente se ha demostrado que
tras 12 semanas de tratamiento con VRN se observaba un descenso
de los niveles de Glutamato/Glutamina en la corteza dorsal del
cingulado anterior cerebral y un descenso significativo de la señal
dependiente de oxígeno en sangre en la corteza medial orbitofrontal-
rostral del cingulado anterior y en la corteza cingulada precunea
posterior(13). Los autores sugieren, según los resultados, un posible
mecanismo de acción de la VRN en reducir los niveles de
glutamato/glutamina en el núcleo accumbens (papel del glutamato en
la modulación de la conducta) y el desplazamiento de la señal
dependiente del oxígeno en sangre en diferentes zonas cerebrales por
lo que se necesitan más trabajos que confirmen y repliquen el
presente. Por otro lado también se ha podido comprobar(14) que la
VRN también estimula la liberación pre-sináptica del GABA, e incluso
la VRN ejerce un efecto de agonista parcial atenuando los efectos de
la nicotina sobre el hipocampo y el cerebro basal anterior lo que
puede afectar claramente a las funciones cognitivas. Sería de gran
importancia ahondar en estos otros efectos de la VRN por conseguir
unas mejores tasas de abstinencia.
Otras nuevas dianas terapéuticas
Dentro de las posibles nuevas dianas terapéuticas para ayudar a
dejar de fumar se podrían incluir:
- Ácido Gamma Amino-Butírico (GABA) y Glutamato
Ya hemos comentado la importancia del ácido gamma amino-butírico
(GABA) y del glutamato en la adicción por la nicotina, por lo que son
varias las moléculas tanto agonistas como antagonistas de ambos
neurotransmisores que han sido y son estudiadas para ayudar a dejar de fumar.
Varias son las moléculas estudiadas y en estudio que actúan sobre el GABA:
1) Baclofen (agonista del receptor GABAB): reduce la liberación
de dopamina en el núcleo accumbens (NA) por la nicotina. En efecto,
ya se había comprobado en estudios llevados a cabo hace años como
el bacoflen reducía en ratas de laboratorio la autoadministración de
nicotina(15). En un trabajo más reciente Franklin et al(16) diseñaron un
piloto de nueve semanas, doble ciego, controlado con placebo con
baclofen en fumadores en estadio de contemplación que no se
encontraban preparados para dejar de fumar y cuyo principal objetivo
fue la reducción del número de cigarrillos al día. Los autores
demostraron la superioridad del baclofen en reducir el número de
cigarrillos fumados al día y además una disminución del craving.
Recientemente se ha podido comprobar como las propiedades
reforzadoras de la nicotina y los efectos negativos secundarios por el
síndrome de abstinencia pueden ser modulados por agonistas del
GABAB como el baclofen(17). En el momento actual existe un ensayo
clínico en marcha que compara baclofen con placebo como ayuda
para dejar de fumar(18), y otro canadiense recientemente terminado
en el que se comparan dos dosis diferentes de baclofen con placebo
para ayudar a dejar de fumar(19).
autoadministración de cocaína, heroína, alcohol y nicotina(15).
Divalproex (agonista GABA): mimetiza la acción
inhibitoria del GABA. En un estudio de 8 semanas, doble ciego se
comparaba divalproex con placebo en 120 fumadores y se medía su
efecto sobre señales de fumador y afectivas intra-tratamiento y se
determinaba si estas señales eran predictoras de la conducta post-
tratamiento de fumador. Contrariamente a las expectativas puestas
en esta molécula, divalproex se asoció a un mayor craving en la
presentación de la señal y no se encontraron diferencias en las tasas
de cesación. El craving suscitado por la señal de fumar predijo el final
del tratamiento y las tasas de fumador post-tratamiento, lo que
sugiere que la señal reactiva intra-tratamiento podría utilizarse como
indicación del desarrollo del tratamiento y como cribaje de posibles
medicaciones para dejar de fumar(20).
4) Pregabalina: análogo del GABA. Es conocido que la
pregabalina atenúa algunos síntomas del síndrome de abstinencia
(ansiedad, irritabilidad y frustración) por la nicotina, pero no ha
demostrado utilidad como medicación para ayudar a dejar de fumar(21).
5) Tiagabine: aumenta los niveles sinápticos de GABA (inhibe la
recaptación). Se ha podido demostrar que el tiagabine reduce el efecto de refuerzo por la nicotina y realza el rendimiento cognitivo(22).
6) Vigabatrin (GVG. γ-vinyl-GABA): inhibidor irreversible de la
GABA transaminasa por lo que disminuye las concentraciones de
dopamina extracelulares. Ya fue demostrado hace años que disminuía la autoadministración de nicotina(23).
7) Zonisamida: en el momento actual existe un ensayo clínico
activo(24) en el que se añade a un grupo de fumadores recalcitrantes
en tratamiento con VRN un segundo medicamento, la zonisamida,
considerado un buen candidato como tratamiento pues incrementa el
tono dopaminérgico, normaliza la homeostasis glutamatérgica y
potencia la liberación del GABA.
- Glutamato.
Varias son las moléculas estudiadas que actúan sobre el glutamato:
MPEP (2 methyl-6-(phenylethynyl)-pyridine): antagonista
del receptor mGluR5; disminuye la autoadministración intravenosa de
2) AZD8529: modulador positivo alostérico selectivo del
receptor mGluR2 del glutamato. Se ha podido comprobar que reduce
la autoadministración de nicotina en monos ardilla, reduce el
"priming" por la nicotina y la señal de búsqueda tras la extinción
previa del refuerzo por la nicotina(25).
3) D-cycloserina (DC): agonista parcial del receptor del
glutamato NMDA. Ya se había observado como la DC reducía en ratas
con bajos niveles de consumo de nicotina la autoadministración de
nicotina, pero no en aquellas con consumos más altos(26). En un
estudio con diseño doble ciego, y comparado con placebo y en el que
los pacientes consumían concomitantemente tabaco y cocaína(27), los
autores no encontraron efectos directos sobre el craving por la
nicotina ni sobre el consumo de cigarrillos diarios. En el momento
actual existen dos ensayos clínicos en marcha en los que se compara DC con placebo como ayuda para dejar de fumar(28,29).
4) Memantina: actúa sobre el sistema glutamatérgico mediante
el bloqueo de los receptores NMDA del glutamato. En el momento
actual ha finalizado un ensayo clínico en el que se compara la
memantina con placebo como ayuda para dejar de fumar a pacientes
con cáncer(30).
Topiramato: antagonista de los receptores AMPA y kainate
glutamatérgicos y facilita la neurotransmisión GABAergica. En una
revisión previa realizada por nosotros sobre el topiramato ya
concluíamos que: 1) Podría ser un prometedor agente para el
tratamiento de la dependencia tabáquica, al menos en los hombres y
alcohólicos a la vez, pues disminuye la liberación de dopamina
inducida por la nicotina 2) Mitiga el síndrome de abstinencia. 3)
Previene la ganancia de peso, pero 4) Son precisos más trabajos pues
no existen conclusiones definitivas(31-33). Recientemente Oncken et
al(34) en un ensayo aleatorizado de 10 semanas, ciego, y en el que
comparaban los efectos del asesoramiento psicológico en combinación
con a) topiramato, b) topiramato/parche de nicotina y,
c) placebo, para ayudar a dejar de fumar, encontraron diferencias
significativas de abstinencia entre el grupo topiramato/parche de
nicotina frente a placebo y no significativas entre el grupo topiramato
frente al placebo. Ambos grupos con topiramato perdieron peso al final del tratamiento.
- Receptores de acetil-colina.
Recientemente Brunzell et al.(35) han comunicado en una estupenda
revisión la importancia de los receptores alfa7 (estimularlo;
agonistas) y alfa6beta2 (inhibirlo: antagonistas) en la abstinencia
tabáquica. Igualmente se ha demostrado como un pre-tratamiento
con Iptakalim(36) (antagonista del receptor alfa4beta2 y facilitador de
los canales de potasio) disminuye la inducción de dopamina por la
nicotina y la liberación del glutamato en el NA, por lo que el Iptakalim
bloquea la respuesta ante la estimulación por la nicotina y mitiga el
efecto producido tras la administración intravenosa de nicotina. La
sazetidina(37), desensibilizador y agonista parcial del receptor
alfa4beta2, se ha comprobado que reduce la autoadministración de
nicotina en ratas de laboratorio. En el momento actual se están
llevando a cabo dos ensayos clínicos con la galantadina(38,39)
(Inhibidor selectivo, competitivo y reversible de la acetilcolinesterasa
que estimula la acción de la acetilcolina sobre los receptores nicotínicos), como ayuda para dejar de fumar.
- Receptores de serotonina.
En un trabajo del pasado mes de julio Zeeb et al.(40) comunicaban
que una inyección de lorcaserin (agonista del receptor HT2C de la
serotonina) antes de una auto-estimulación intracraneal con nicotina
bloqueaba su efecto de recompensa. En el momento actual existe un
ensayo clínico en marcha que examina el efecto de la psylocibina(41)
(Alucinógeno, agonista parcial de receptores serotoninergicos) como
ayuda para dejar de fumar comparándola con parches de nicotina.
- Monoaminooxidasa.
Diferentes estudios preclínicos y clínicos han demostrado que los
fumadores crónicos presentan una actividad monoaminooxidasa A
(MAO–A) y B (MAO–B) disminuida, que se normaliza tras la cesación
del consumo. Hace unos años el grupo de Berlin et al.(42) no demostró
diferencias significativas con el EVT302 (inhibidor selectivo del MAO-
B) sólo o añadiéndole parches de nicotina para ayudar a dejar de
fumar, ni tampoco la selegilina (inhibidor transdérmico MAO) en el
trabajo de Kahn et al.(43).
- Agonistas alfa2a noradrenérgicos.
El estrés y la disfunción cognitiva prefrontal juegan un papel esencial
en el consumo de tabaco, sin embargo no existe medicación que
atenúe el estrés por fumar y el realce cognitivo. Vías centrales
noradrenérgicas se encuentran envueltas en el estrés inducido por la
falta de nicotina y en el control de conductas adaptativas pre-
frontales. Por ello, McKee et al.(44), emplearon un validado simulador
de estrés por fumar, imágenes funcionales de resonancia magnética y
la evaluación de si la guanfacina (agonista alfa2a noradrenérgico)
comparada con placebo reducía el estrés por la falta de nicotina,
alteraba la activación cortico-estriatal y reducía el consumo tras un
intento de dejar de fumar. Los autores observaron cómo en los
fumadores del grupo placebo deprivados una situación de estrés
disminuía la latencia de tiempo para fumar, incrementando el craving.
En cambio en los del grupo de la guanfacina dicho efecto estaba
ausente o se reducía. La guanfacina alteraba la actividad pre-frontal y
reducía el consumo de cigarrillos pero sin una completa abstinencia.
En el momento actual se encuentra en marcha un ensayo clínico que
compara guanfacina para dejar de fumar con placebo(45).
Otras posibilidades terapéuticas.
- Cigarrillo electrónico (CE): hasta la actualidad el CE no ha
demostrado científicamente ni eficacia ni efectividad para dejar de
fumar. En estos momentos están en marcha ensayos clínicos que
utilizan CE como ayuda para dejar de fumar. Uno de ellos compara CE
con y sin nicotina con parches de nicotina y asesoramiento(46),
otro(47), realizado en Canadá, compara CE con nicotina y sin nicotina,
más leve asesoramiento conductual con sólo asesoramiento
conductual. En otro(48) se compara el tratamiento estándar con
tratamiento estándar más CE. Otros dos ensayos, ya finalizados
comparan el CE con un inhalador de nicotina(49) y con chicles de
nicotina(50) para ayudar a dejar de fumar.
- Simvastatina: Es conocido que la simvastatina reduce la conducta
de búsqueda por la nicotina en ratas de laboratorio, por ello el grupo
de la Universidad de Poitiers(51) lleva adelante en el momento actual
un ensayo clínico activo en el que se compara la simvastatina (20
mg) con placebo para ayudar a dejar de fumar.
- Estimulación intracraneal magnética (EIM): Es conocido que la
EIM ha sido evaluada como tratamiento de varios desórdenes
neuropsiquiátricos que presentan una actividad dopaminérgica
anormal y una excitabilidad cortical alterada. Varios trabajos han
demostrado como una EIM repetida reduce el craving y el número de
cigarrillos consumidos al día en pacientes fumadores. Dinur-Klein et
al.(52) demostraron recientemente que una EIM de alta frecuencia
(pero no baja) reducía, de forma significativa el consumo de
cigarrillos y la dependencia por la nicotina. La combinación de este
tratamiento con la exposición a señales asociadas al consumo de
tabaco reduce el consumo de tabaco hasta conseguir una abstinencia
del 44% al final del tratamiento y estimada del 33% tras un
seguimiento de 6 meses. Pripfl et al.(53) observaron como al aplicar
EIM de alta frecuencia en el cortex pre-frontal dorsolateral izquierdo
cerebral se reducía el craving por la nicotina en fumadores
recientemente abstinentes. Abogan que los cambios en la actividad
delta cerebral se deben a que los efectos de la EIM están mediados
por el sistema dopaminérgico de recompensa y que probablemente
juegue un papel, aunque seguramente no el único en la modulación
conductual. En el momento actual existe un ensayo clínico activo que
analiza la EIM como método para reducir el craving y el consumo de
cigarrillos(54).
- Mindfulness: en el momento actual existen en activo varios
estudios que analizan las posibilidades del Mindfulness como ayuda
para dejar de fumar pues intenta separar el craving del consumo de tabaco(55).
- Vacuna antinicotina (VA): diversos trabajos previos han
demostrado que la VA podría lograr la abstinencia tabáquica pero ésta
no ha sido capaz de conseguir concentraciones suficientes en sangre
de anticuerpos para lograrlo(56). En la actualidad se estudian nuevas
estrategias para conseguir una mayor eficacia o proveer de
anticuerpos de forma más rápida y en mayor concentración por otros
mecanismos: se quiso conseguir una nueva proteína conjugada
mediante modificaciones de haptenos u optimizando su densidad,
utilizando una vacuna de nanopartículas, conexiones pasivas de
anticuerpos específicos monoclonales de nicotina, vectores virales
como conexiones de genes para la producción de anticuerpos, pero
todos ellos están todavía por demostrar eficacia.
En busca de biomarcadores como ayuda para dejar de fumar.
La investigación previa existente examinaba como predictores de
cesación diferentes datos clínicos como los niveles de dependencia
tabáquica, el craving y la autoeficacia. En el momento actual los
biomarcadores que han demostrado utilidad en la clínica para
predecir cesación tabáquica en respuesta a diferentes tratamientos
son: datos clínicos, el genotipo, la razón de metabolitos de nicotina y las imágenes cerebrales(57).
- Enfocado en variables clínicas:
Fumar y cesación positiva:
Bajo craving basal
Nº de cig fumados al día.
Con variables demográficas:
Nivel educacional alto
Factores psicológicos asociados a una respuesta + al tto:
Niveles altos de auto-eficacia
Estar preparado y motivado
Niveles bajos de estrés
Sin historia de depresión
Afectos negativos bajos
Factores relacionados con el tto:
Soporte conductual
Ausencia de caídas al principio
En un estudio reciente Jiménez Ruiz et al.(58) analizaron diferentes
variables clínicas con el objetivo de definir combinaciones de dichas
variables que permitieran elegir el mejor tratamiento en la práctica
clínica. Los autores encontraron que 1) la terapia sustitutiva con
nicotina no es recomendable en sujetos de cualquier edad con
dependencia alta (9 o 10 puntos en el test de Fagerström o
fumadores de su primer cigarrillo de la mañana en menos de 5
minutos tras levantarse), 2) en aquellos fumadores con dependencia
alta y edad avanzada el tratamiento que funciona mejor es el
bupropion o la VRN, 3) aquellos sujetos menores de 20 años con una
dependencia moderada/alta por la nicotina (test de Fagerström ≥ 6 y
menos de 30 minutos hasta el primer cigarrillo tras levantarse) son
resistentes a cualquier tipo de tratamiento, 4) sujetos con baja
dependencia por la nicotina pueden ser tratados con cualquier tipo de
tratamiento pero los mejores resultados se obtienen con bupropion o VRN.
Enfocado en genotipos: se ha demostrado que genes
relacionados con el receptor de acetilcolina y con las proteínas
relacionadas predicen la respuesta a la medicación de primera línea
de tratamiento o a la abstinencia en el tiempo sin un control de
ensayo de tratamiento(57).
Enfocado en marcadores de nicotina (razón de metabolitos de
nicotina): los niveles de nicotina y cotinina sirven como marcadores
de consumo y abstinencia: la nicotina va a ser metabolizada en el 70
al 80% en el sistema citocromo P450 por la enzima CYP2A6 a cotinina
y ésta a su vez es metabolizada a trans-3´-hydroxycotinina (3HC)
igualmente por la enzima CYP2A6. Debido a su larga vida media la
cotinina ha sido empleada como marcador de consumo e incluso
como verificador de abstinencia. La razón de metabolitos de la
nicotina (NMR): razón 3HC/cotinina (NMR) se utiliza como marcador
del aclaramiento de la nicotina y refleja la variabilidad individual en el
metabolismo de la nicotina y cotinina debida a la variación de la
actividad del CYP2A6 que está mediada genéticamente y por el
entorno. Fumadores con un NMR alto nos están indicando un rápido
aclaramiento de la nicotina y se asocia a un fumador severo y con
más bajas tasas de abstinencia, probablemente debido a una mayor
severidad del craving y de los síntomas del síndrome de abstinencia.
La razón NMR es estable en sangre, plasma y saliva en diferentes
condiciones por lo que una sola medición del NMR es fiable(57). Se ha
demostrado que los metabolizadores rápidos de la nicotina presentan
unas menores tasas de abstinencia con placebo pero éstas se
incrementan con bupropion, lo que nos indica que no podemos
obtener un mayor beneficio con bupropion en metabolizadores lentos.
Variaciones genéticas que den como resultado una baja actividad
CYP2A6 afectan de forma significativa el consumo de cigarrillos, el
aclaramiento de nicotina y los niveles metabólicos de nicotina, pues
metabolizadores lentos tendrán un bajo aclaramiento de nicotina y
una baja razón NMR, generalmente definida como la presencia de una
actividad reducida o nula de alelos CYP2A6 o un valor NMR en el
cuartil más bajo o en la mitad baja de la distribución(57). Ho et al.(59)
ya hace tiempo, utilizando estimaciones del metabolismo de la
nicotina definiéndolo como variaciones genéticas del CYP2A6
demostraron que en fumadores con ancestros africanos con
variaciones del CYP2A6 asociadas a una actividad enzimática baja y
aleatorizados a chicles de nicotina o placebo tenían más
probabilidades de mantenerse abstinentes que aquellos con una
actividad enzimática normal. Igualmente Lerman et al.(60) estudiaron
a fumadores que fueron aleatorizados a un tratamiento estándar de 8
semanas con parches de nicotina comparado con un tratamiento de 6
meses encontrando que aquellos con una variante CYP2A6 asociada a
un reducido metabolismo se beneficiaban más del tratamiento más
largo que los que presentaban un metabolismo normal de nicotina
manteniéndose abstinentes con mayor probabilidad a las 24
semanas. En un ensayo clínico Lerman et al.(61) demostraron que la
razón NMR predecía abstinencia utilizando parches de nicotina pero
no con espray nasal. Asimismo, Schnoll et al.(62) validaron la razón
NMR como predictor de abstinencia en un estudio de un solo brazo
con parches de nicotina durante 8 semanas. Recientemente, Lerman
et al.(63), en un estudio prospectivo en el que se estratificaba por NMR
y se aleatorizaba a los fumadores a tres tratamientos (dos activos;
VRN y parches de nicotina y uno placebo) se identificó una
interacción del NMR por tratamiento al final del mismo (6 meses) de
tal manera que los matabolizadores normales aleatorizados a VRN
exhibían una significativa mayor abstinencia al compararlo con
aquellos fumadores aleatorizados a parches de nicotina, y la eficacia
de VRN y de los parches fue, en cambio, la misma en aquellos
fumadores metabolizadores lentos.
Aunque la enzima principal responsable del metabolismo de la
nicotina es la CYP2A6, variaciones genéticas en la CYP2B6 son
también importantes en la respuesta al tratamiento para la cesación
tabáquica. Dicha enzima es la principal metabolizadora del bupropion.
Se ha demostrado como polimorfismos que disminuyan la actividad
del CYP2B6 aumentan las recaídas al comparar bupropion y placebo,
al contrario que aquellos polimorfismos que incrementen la actividad
de la enzima que aumentan las tasas de abstinencia con
- Enfocado en imágenes cerebrales: un área emergente
deinvestigación es el uso de imágenes cerebrales para determinar
biomarcadores de cesación tabáquica. Las modalidades de imágenes
incluyen la resonancia magnética anatómica cerebral, la resonancia
magnética espectroscópica y la tomografía por emisión de positrones(57).
Dejar de fumar de forma gradual ha demostrado efectividad.
La vareniclina ha demostrado seguridad, efectividad y
coste/efectividad para ayudar a dejar de fumar. Recientemente ha
demostrado efectividad para ayudar a dejar de fumar al compararlo
con placebo en fumadores que reducen su consumo de forma gradual
Son numerosas las nuevas dianas terapéuticas en estudio para
ayudar a dejar de fumar: agonistas y antagonistas del GABA y del
glutamato, agonistas y antagonistas de receptores de acetilcolina,
serotoninérgicos,
monoaminooxidasa, agonistas noradrenérgicos.
El cigarrillo electrónico requiere posicionarse en el momento
actual como tratamiento para dejar de fumar.
La Estimulación Intracraneal Magnética se ha mostrado como
una herramienta prometedora en el control del craving y en la
reducción del consumo de cigarrillos.
Los biomarcadores que han demostrado utilidad para predecir
cesación tabáquica son: clínicos, genotípicos, la razón de metabolitos
de la nicotina (NMR) y las imágenes cerebrales.
1) Encuesta Nacional de Salud de España 2011/12. Ministerio de
Sanidad, Servicios Sociales e Igualdad. Madrid, 2012. [Consultado
2) El programa MPOWER y la epidemia mundial del tabaquismo.
Estrategia MPOWER. Organización Mundial de la Salud. Ginebra,
3) Fiore MC, Jaen CR, Baker TB et al. Treating tobacco use and
dependence: 2008 update. Rockville (MD): US Dept. Health and
Human Services, Public Health Service, 2008. [Accedido 24 de abril
4) Hughes JR. An updated algorithm for choosing among smoking cessation treatments. J Subst Abuse Treat. 2013; 45: 215-21.
5) Lindson-Hawley N1, Aveyard P, Hughes JR. Reduction versus
abrupt cessation in smokers who want to quit. Cochrane Database
6) Schauer GL, Malarcher AM, Babb SD. Gradual reduction of
cigarette consumption as a cessation strategy: prevalence, correlates, and relationship with quitting. Nicotine Tob Res. 2015; 17: 530 – 8.
7) Cahill K1, Stevens S, Perera R, Lancaster T. Pharmacological
interventions for smoking cessation: an overview and network meta-
analysis. Cochrane Database Syst Rev. 2013 May 31; 5: CD009329. doi: 10.1002/14651858.CD009329.pub2.
8) Ebbert JO, Hughes JR, West RJ, Rennard SI, Russ C, McRae TD, et
al. Effect of varenicline on smoking cessation through smoking reduction: a randomized clinical trial. JAMA. 2015; 313: 687-94.
9) Jiménez-Ruiz CA, Barrios M, Peña S, Cicero A, Mayayo M, Cristóbal
M, Perera L. Increasing the dose of varenicline in patients who do not respond to the standard dose. Mayo Clin Proc. 2013; 88: 1443 - 5.
10) Hajek P, McRobbie H, Myers Smith K, Phillips A, Cornwall D,
Dhanji AR. Increasing varenicline dose in smokers who do not
respond to the standard dosage: a randomized clinical trial. JAMA
Intern Med. 2015 ; 175: 266 - 71.
11) Chang PH, Chiang CH, Ho WC, Wu PZ, Tsai JS, Guo FR.
Combination therapy of varenicline with nicotine replacement therapy
is better than varenicline alone: a systematic review and meta-
analysis of randomized controlled trials. BMC Public Health. 2015; 15: 689. doi: 10.1186/s12889-015-2055-0.
12) McClure EA, Baker NL, Gipson CD, Carpenter MJ, Roper AP,
Froeliger BE, et al. An open-label pilot trial of N-acetylcysteine and
varenicline in adult cigarette smokers. Am J Drug Alcohol Abuse.
13) Wheelock MD, Reid MA, To H, White DM, Cropsey KL, Lahti AC.
Open label smoking cessation with varenicline is associated with
decreased glutamate levels and functional changes in anterior
cingulate cortex: preliminary findings. Front Pharmacol. 2014; 5: 158. doi: 10.3389/fphar.2014.00158. eCollection 2014.
14) DuBois DW, Damborsky JC, Fincher AS, Frye GD, Winzer-Serhan
UH. Varenicline and nicotine enhance GABAergic synaptic
transmission in rat CA1 hippocampal and medial septum/diagonal
band neurons. Life Sci. 2013; 92: 337 - 44.
15) Paterson NE, Froestl W, Markou A. The GABAB receptor agonists
baclofen and CGP44532 decreased nicotine self-administration in the rat. Psychopharmacology (Berl). 2004; 172: 179 - 86.
16) Franklin TR, Harper D, Kampman K, Kildea-McCrea S, Jens W,
Lynch KG, et al. The GABA B agonist baclofen reduces cigarette
consumption in a preliminary double-blind placebo-controlled smoking reduction study. Drug Alcohol Depend. 2009; 103: 30 - 6.
17) Varani AP, Aso E, Moutinho LM, Maldonado R, Balerio GN.
Attenuation by baclofen of nicotine rewarding properties and nicotine
withdrawal manifestations. Psychopharmacology (Berl). 2014; 231: 3031 – 40.
18) Baclofen effects in cigarettes smokers (BAC). ClinicalTrials. Gov
NCT01821560. [Accedido 20 de agosto de 2015]. Disponible en:
19) Baclofen for smoking cessation in non-psychiatric population.
ClinicalTrials. Gov NCT 01228994. [Accedido 20 de agosto de 2015].
20) Ditre JW, Oliver JA, Myrick H, Henderson S, Saladin ME, Drobes
DJ. Effects of divalproex on smoking cue reactivity and cessation
outcomes among smokers achieving initial abstinence. Exp Clin Psychopharmacol. 2012; 20: 293 - 301.
21) Herman AI, Waters AJ, McKee SA, Sofuoglu M. Effects of
pregabalin on smoking behavior, withdrawal symptoms, and cognitive
performance in smokers. Psychopharmacology (Berl). 2012; 220: 611 - 7.
22) Sofuoglu M, Mouratidis M, Yoo S, Culligan K, Kosten T. Effects of
tiagabine in combination with intravenous nicotine in overnight abstinent smokers. Psychopharmacology (Berl). 2005; 181: 504 - 10.
23) Paterson NE, Markou A. Increased GABA neurotransmission via
administration of gamma-vinyl GABA decreased nicotine self-administration in the rat. Synapse. 2002; 44: 252 – 3.
24) Zonisamide Augmentation of Varenicline Treatment for Smoking
Cessation (1207). ClinicalTrials.Gov NCT01685996. [Accedido 23 de
25) Justinova Z, Panlilio LV, Secci ME, Redhi GH, Schindler CW, Cross
AJ, et al. The Novel Metabotropic Glutamate Receptor 2 Positive
Allosteric Modulator, AZD8529, Decreases Nicotine Self-Administration
and Relapse in Squirrel Monkeys. Biol Psychiatry. 2015 Feb 7. pii: S0006-3223(15)00083-9. doi: 10.1016/j.biopsych.2015.01.014.
26) Levin ED, Slade S, Wells C, Petro A, Rose JE. D-cycloserine
selectively decreases nicotine self-administration in rats with low
baseline levels of response. Pharmacol Biochem Behav. 2011; 98: 210 - 4.
27) Yoon JH1, Newton TF, Haile CN, Bordnick PS, Fintzy RE,
Culbertson C, et al. Effects of D-cycloserine on cue-induced craving
and cigarette smoking among concurrent cocaine- and nicotine-
dependent volunteers. Addict Behav. 2013; 38: 1518-26.
28) D-cycloserine (DCS) Pretreatment + Cognitive Behavioral
Therapy and Nicotine Replacement Therapy for Smoking Cessation
(DCS). ClinicalTrial. Gov NCT01842334. [Accedido 23 de agosto de
2015].Disponible
29) Investigation of Cycloserine as a Smoking Cessation Treatment.
ClicalTrials.Gov NCT01062932. [Accedido 23 de agosto de 2015].
30) Memantine Hydrochloride in Helping Cancer Survivors Stop
Smoking. ClinicalTrials.Gov NCT01535040. [Accedido 23 de agosto de
31) Schiffer WK, Gerasimov MR, Marsteller DA, Geiger J, Barnett C,
Alexoff DL, et al. Topiramate selectively attenuates nicotine-induced increases in monoamine release. Synapse. 2001; 42:196 - 8.
32) Johnson BA, Ait-Daoud N, Akhtar FZ, Javors MA. Use of oral
topiramate to promote smoking abstinence among alcohol-dependent
smokers: a randomized controlled trial. Arch Intern Med. 2005; 165: 1600 - 5.
33) Anthenelli RM, Blom TJ, McElroy SL, Keck PE. Preliminary
evidence for gender-specific effects of topiramate as a potential aid to
smoking cessation. Addiction. 2008; 103: 687 - 94.
34) Oncken C, Arias AJ, Feinn R, Litt M, Covault J, Sofuoglu M,
Kranzler HR. Topiramate for smoking cessation: a randomized, placebo-controlled pilot study. Nicotine Tob Res. 2014; 16: 288 - 96.
35) Brunzell DH, McIntosh JM, Papke RL. Diverse strategies targeting
α7 homomeric and α6β2* heteromeric nicotinic acetylcholine
receptors for smoking cessation. Ann N Y Acad Sci. 2014; 1327: 27-45.
36) Charntikov S, Swalve N, Pittenger S, Fink K, Schepers S, Hadlock GC, et al. Iptakalim attenuates self-administration and acquired goal-
tracking behavior controlled by nicotine.Neuropharmacology. 2013;
37) Johnson JE, Slade S, Wells C, Petro A, Sexton H, Rezvani AH, et
al Assessing the effects of chronic sazetidine-A delivery on nicotine
self-administration
Psychopharmacology (Berl). 2012; 222: 269 - 76.
ClinicalTrials.Gov NCT NCT01845961. [Accedido 24 de agosto de
39) Effect of Galantamine on Short-term Abstinence (GAL-K).
ClinicalTrials.Gov NCT NCT01669538. [Accedido 24 de agosto de
40) Zeeb FD, Higgins GA, Fletcher PJ. The Serotonin 2C Receptor
Agonist Lorcaserin Attenuates Intracranial Self-Stimulation and Blocks
the Reward-Enhancing Effects of Nicotine. ACS Chem Neurosci. 2015; 6: 1231 – 40.
41) Psilocybine-facilitated smoking cessation treatment: A Pilot
Study. ClinicalTrials.Gob NCT01943994. [Accedido 25 de agosto de
42) Berlin I, Hunneyball IM, Greiling D, Jones SP, Fuder H, Stahl HD.
A selective reversible monoamine oxidase B inhibitor in smoking
cessation: effects on its own and in association with transdermal nicotine patch. Psychopharmacology (Berl). 2012; 223: 89 - 98.
43) Kahn R, Gorgon L, Jones K, McSherry F, Glover ED, Anthenelli RM,
et al. Selegiline transdermal system (STS) as an aid for smoking cessation. Nicotine Tob Res. 2012; 14: 377 - 82.
44) McKee SA, Potenza MN, Kober H, Sofuoglu M, Arnsten AF,
Picciotto MR, et al. A translational investigation targeting stress-
reactivity and prefrontal cognitive control with guanfacine for smoking cessation. J Psychopharmacol. 2015; 29: 300 – 11.
45) Guanfacine clinical trial for smoking cessation. ClinicalTrials.Gov
NCT02051309. [Accedido 26 de agosto de 2015]. Disponible en:
46) The Use of Nicotine Patches Together With E-cigarettes (With and
ClinicalTrials.Gov NCT02521662. [Accedido 26 de agosto de 2015].
47) Evaluating the Efficacy of E-Cigarette Use for Smoking Cessation
(E3) Trial. ClinicalTrials.Gov NCT02417467. [Accedido 26 de agosto de
48) Spain-UK-Czech E-cigarette Study ((SUKCES)). ClinicalTrials.Gov
NCT01842828. [Accedido 26 de agosto de 2015]. Disponible en:
49) Electronic Cigarettes or Nicotine Inhaler for Smoking Cessation.
ClinicalTrials.Gov NCT02004171. [Accedido 26 de agosto de 2015].
50) E-Cigarettes Versus NRT Gum for Smoking Cessation.
ClinicalTrials.Gov NCT01925781. [Accedido 26 de agosto de 2015].
51) Trial to Evaluate the Efficacy of Simvastatin for Smoking
ClinicalTrials.Gov
52) Dinur-Klein L, Dannon P, Hadar A, Rosenberg O, Roth Y, Kotler M,
et al. Smoking cessation induced by deep repetitive transcranial
magnetic stimulation of the prefrontal and insular cortices: a
prospective, randomized controlled trial. Biol Psychiatry. 2014; 76: 742 - 9.
53) Pripfl J, Tomova L, Riecansky I, Lamm C. Transcranial magnetic
stimulation of the left dorsolateral prefrontal cortex decreases cue-
induced nicotine craving and EEG delta power. Brain Stimul. 2014; 7: 226 - 33.
54) rTMS for Smoking Cessation. ClinicalTrials.Gov NCT02401672.
55) A Mindfulness Based Application for Smoking Cessation (MBSC).
. ClinicalTrials.Gov NCT01982109. [Accedido 29 de agosto de 2015].
56) Pentel PR, LeSage MG. New directions in nicotine vaccine design and use. Adv Pharmacol. 2014; 69: 553-80.
57) Mamoun M, Bergen AW, Shieh J, Wiggins A, Brody AL. Biomarkers
of Response to Smoking Cessation Pharmacotherapies: Progress to
Date. CNS Drugs. 2015; 29: 359 - 69.
58) Jiménez Ruiz CA,
59) Ho MK, Mwenifumbo JC, Al Koudsi N, Okuyemi KS, Ahluwalia JS,
Benowitz NL, et al. Association of nicotine metabolite ratio and
CYP2A6 genotype with smoking cessation treatment in African-
American light smokers. Clin Pharmacol Ther. 2009; 85: 635 – 43.
60) Lerman C, Jepson C, Wileyto EP, Patterson F, Schnoll R, Mroziewicz M, et al. Genetic variation in nicotine metabolism predicts
the efficacy of extended-duration transdermal nicotine therapy. Clin Pharmacol Ther. 2010; 87: 553 – 7.
61) Lerman C, Tyndale R, Patterson F, Wileyto EP, Shields PG, Pinto A,
et al. Nicotine metabolite ratio predicts efficacy of transdermal
nicotine for smoking cessation. Clin Pharmacol Ther. 2006; 79: 600–
62) Schnoll RA, Patterson F, Wileyto EP, Tyndale RF, Benowitz N,
Lerman C. Nicotine metabolic rate predicts successful smoking
cessation with transdermal nicotine: a validation study. Pharmacol
Biochem Behav. 2009; 92: 6 – 11.
63) Lerman C, Schnoll RA, Hawk LW Jr, Cinciripini P, George TP,
Wileyto EP, et al. Use of the nicotine metabolite ratio as a genetically
informed biomarker of response to nicotine patch or varenicline for
smoking cessation: a randomised, double-blind placebo-controlled
trial. Lancet Respir Med. 2015; 3: 131 – 8.
CÁNCER DE PULMÓN: ¿DÓNDE ESTAMOS, QUÉ FUTURO SE PREVÉ?
Dr. Jesús R. Hernández Hernández
Sección de Neumología. Complejo Asistencial de Ávila
Conocer los aspectos epidemiológicos básicos relacionados con
el cáncer de pulmón (CP) resulta de gran interés para aquilatar la
verdadera magnitud o impacto que tiene esta enfermedad en nuestro
entorno geográfico. De ello dependerán aspectos como la
planificación de recursos presentes y futuros (asistenciales, sociales,
económicos, investigación, etc.), o la implementación de medidas de prevención en colectivos específicos.
El consumo de tabaco es el mayor responsable de esta
enfermedad, de alrededor del 90% de los casos (1), y la evolución de
tabaquismo (tiempos, intensidad, etc.) condiciona drásticamente la
incidencia del CP, con características diferenciadas en los distintos
países y en ambos sexos. Los avances realizados en prevención
esperamos que reduzcan la importancia etiológica de los carcinógenos
del medio laboral, pero emerge la conciencia de riesgo derivado de la
exposición a otros agentes como el Radón (1,2). Necesitamos,
realmente, implementar una estrategia preventiva eficaz ya que, a
pesar de los avances que se vienen apreciando en los procedimientos
de diagnóstico, estadificación y tratamiento, la supervivencia neta, la
derivada del tumor, era sólo del 12,6% en pacientes españoles
diagnosticados entre 2005 y 2009 (3).
¿Dónde estamos?
De acuerdo con la información recogida por la agencia
internacional para la investigación del cáncer (IARC), dependiente de
la OMS, en su base de datos Globocan que contiene estimaciones
epidemiológicas para el año 2012 (4), el CP fue el tumor más
frecuente en el mundo (1,82 millones de casos) y el que ocasionó
mayor mortalidad (1,59 millones). En hombres fue el primero en
incidencia y mortalidad ocupando en las mujeres el tercer y segundo
puesto respectivamente. Las mayores tasas de incidencia y
mortalidad por CP se encontraban en los países de centro-este de
Europa y del este de Asia para los hombres. En estos, ocupaba
España el lugar vigésimo, con tasas de incidencia de 52,5 casos por
cien mil ajustadas por edad a población mundial estándar (APMS)
frente a las 76,6 por cien mil, APMS, de Hungría, el primero. En el
colectivo de mujeres las mayores tasas mundiales se hallaban en el
norte de América y de Europa, encontrándose aún las españolas en
tasas de incidencia de 11,3 casos por cien mil, APMS, inferiores a la
media de la Europa del sur, 12,8 por cien mil, APMS y alejadas de las danesas, 37,6 por cien mil, APMS. Tabla 1.
Entre los varones de nuestro país el CP ocupó en 2012 el
segundo puesto en tumores incidentes, tras el de próstata, pero fue
el primero en mortalidad, y en las mujeres el CP ocupó el cuarto lugar
en cifras de incidencia, tras el de mama, colon-recto y útero, pero ya
el tercero en mortalidad, tras el colo-rectal y el de mama (4). De
acuerdo con datos publicados por el Instituto Nacional de Estadística,
en el año 2013 el CP fue responsable de 17.577 fallecimientos, un
26% de los derivados de tumores en los hombres y de 4.112
defunciones, un 9,5% de las acontecidas por neoplasias entre las
mujeres (5). Los datos, también referidos al año 2013, recogidos en
la colaboración internacional "The Global Burden of Cancer", indican
que en el conjunto de la población española el tumor con mayor
incidencia fue el colo-rectal, seguido del de próstata y del CP (6).
A nivel regional contamos con información sobre la incidencia
del CP meced al estudio realizado por la Sociedad Castellano-Leonesa
y Cántabra de Patología Respiratoria (Socalpar) en las comunidades
de Castilla-León y Cantabria (7). También existen registros de
tumores dependientes de los Servicios de Salud en ambas
comunidades desde hace ya varios años. El trabajo patrocinado por
Socalpar aporta datos correspondientes a 2007 que, además, son
comparados con los obtenidos 10 años antes en la comunidad
castellano-leonesa (8). En esta comunidad, las mayores tasas brutas
de incidencia del CP en 2007 se encontraron en León, tanto en
hombres, 116,9 casos por cien mil, como en mujeres, 15,72 por cien
mil, y las más bajas en los hombres de Soria, 61,47 por cien mil, y
las mujeres de Segovia, 2,54 casos por cien mil. En Cantabria las
tasas brutas de incidencia más altas fueron 101,7 por cien mil en
hombres y 19,14 por cien mil en las mujeres. En parte estos
resultados se mantienen ya que las tasas brutas de mortalidad
provincial por CP más recientes, las correspondientes al año 2013,
sitúan a los hombres de León en el tercer lugar, (tabla 2), y a las
mujeres de Cantabria en el cuarto puesto entre todas las provincias españolas, (tabla 3) (9).
¿Cómo hemos llegado hasta aquí?
Sabemos que la curva de evolución seguida por las tasas de
cáncer de pulmón es paralela, con un retraso de 20 - 30 años, a la
curva del consumo de tabaco en una población determinada. Se
observa, por tanto, que en los países más industrializados que
iniciaron y comenzaron a reducir antes el consumo, la incidencia del
CP viene descendiendo desde los años 90 y por el contrario, los
países menos desarrollados, en los que aún sigue ascendiendo el
consumo, también lo hace actualmente la incidencia del CP (6). En
España, los datos de mortalidad están disponibles anualmente desde
hace décadas y resultan especialmente útiles para analizar la
evolución de la enfermedad. En hombres, fumadores en proporción
significativa y creciente desde la década de los 40 hasta mediados de
los 80, las tasas brutas de mortalidad ascendieron de manera
importante hasta mediados de los 90, después más lentamente hasta
el máximo de 82,3 casos por cien mil habitantes en 2001, fecha a
partir de la cual se ha comprobado una estabilización de dichas tasas
de mortalidad (10). Sin embargo el número absoluto de
fallecimientos sigue aumentando año tras año (10). En este contexto,
la referida estabilización de las tasas muy probablemente tenga
relación con el aumento de la población del país por la llegada de
personas inmigrantes de edades relativamente jóvenes entre los
cuales no es frecuente el CP. En las mujeres españolas se observó un
aumento del tabaquismo a partir de los años 60-70 hasta los
primeros 2000, siempre con una intensidad claramente inferior a la
apreciada en hombres. Se ha producido en ellas un incremento
brusco de las tasas brutas de mortalidad por CP, también de los
fallecimientos, en menor medida, a partir del año 90 (6,6 por cien
mil) hasta al menos 2012 (16,3 por cien mil), como vemos con una
magnitud muy inferior a la de los varones. Los datos de hombres y
mujeres referentes a Castilla-León y a Cantabria siguen, a grandes
rasgos, unas tendencias similares a las españolas, con unas cifras
próximas a la media los castellano-leoneses y por encima los de
Cantabria (10). Los estudios de incidencia realizados en Castilla y
León por Socalpar confirman los aumentos de tasas entre el año 1997 y el 2007, especialmente en las mujeres (7,8).
¿Qué futuro se prevé?
Varios factores tienen capacidad de influir en las tendencias que
puede presentar el CP en los próximos años, aunque es difícil calcular el peso atribuible a cada uno de ellos en el conjunto.
1º. Sabemos que, especialmente en varones, las tasas más elevadas
de CP tienen lugar en las edades avanzadas, figura 1, y cada vez son
mayores las edades a las que se diagnostica y fallecen las personas
por el tumor. También que la proporción de personas en España que
contarán con 65 y más años se encuentra en continuo ascenso, con
previsiones de alcanzar en torno al 20% en 2021, al 24% en 2031, al
29% en 2041 y al 32% en 2049 (11). Estas circunstancias favorecerán el aumento futuro del número de casos de CP.
2º. La disminución observada en el consumo de tabaco en los
hombres españoles en los primeros años de la década de los 80
puede estar ya influyendo a favor de la reducción del número de
casos en el colectivo, a juzgar por el lapso de 20-30 años apreciado
entre el descenso del consumo y reducción de mortalidad por CP
comprobado en otros países en los que los hábitos del consumo de
tabaco precedieron varias décadas a los del nuestro (12). Entre las
mujeres españolas la disminución del tabaquismo apreciada en los
primeros años 2000 no esperamos aún que tenga un efecto reductor
de la mortalidad por CP.
3º. En la década pasada se produjo un incremento importante de la
población inmigrante en España que llegó a suponer el 12,2% del
total en 2011 con el consiguiente aumento del denominador en el
cálculo de tasas y disminución de las mismas. Estas personas que
contaban con una mediana de edad de 32,9 años (13), jóvenes por
tanto, están actualmente alejados de las edades que presentan
nuestros pacientes diagnosticados de CP. Su influencia en las cifras
futuras del CP en España dependerá de si permanecen en el país o se producen fenómenos de salidas o llegadas significativas.
Teniendo en cuenta lo anterior, no es extraño que en las
mujeres españolas las previsiones para, al menos, los próximos 10
años, realizadas en algunas comunidades autónomas y a nivel
nacional, tanto para casos nuevos, fallecimientos por el tumor o
tasas, indican que se mantiene el ascenso (4,14). El hecho de que las
tasas estandarizadas por edad muestren un crecimiento claro en las
mujeres relativamente jóvenes apoya la previsión de que la
enfermedad, y los problemas de ella derivados, seguirán
aumentando. Más compleja resulta la previsión para los varones en
los cuales el envejecimiento progresivo favorece la aparición de casos
de CP, pero la reducción paulatina del consumo de tabaco actúa en
contra y es difícil prever el impacto de la inmigración. Los estudios
disponibles, apoyados por la disminución observada desde hace
tiempo en las tasas estandarizadas en todas las franjas de edad,
coinciden en que la tendencia a la disminución de las tasas apreciada
en los últimos años se va a mantener, pero, desafortunadamente,
también se piensa que las cifras absolutas de casos nuevos o fallecimientos por CP pueden seguir en ascenso (4,14).
La realidad nos enseñará hasta qué punto han sido, son y serán
importantes las medidas preventivas (tabaco, ocupación, radón, etc)
y los avances clínicos o terapéuticos que se están produciendo en el
campo del CP. Seguiremos pendientes de la epidemiología de este tumor.
1. Alberg AJ, Brock MV, Ford JG, Samet JM, Spivack SD.
of lung cancer: Diagnosis and management of lung
cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143(5 Suppl):1S-29S
2. Ridge CA, McErlean AM, Ginsberg MS. of lung cancer. Semin Intervent Radiol. 2013;30:93-8.
3. Allemani C, Weir HK, Carreira H, et al. of
cancer survival 1995-2009: analysis of individual data for 25,676,887
patients from 279 population-based registries in 67 countries (CONCORD-2). Lancet 2015 Mar 14;385(9972):977-1010
4. International Agency for Research in Cancer (IARC). Research
Cancer Statistics Resources. Databases. Globocan. Disponible en:
5. Instituto Nacional de Estadística (INE). INEbase. Sociedad. Salud.
Defunciones según la causa de muerte. Disponible en:
6. Fitzmaurice C, Dicker D, Pain A, et al. lobal Burden of Cancer 2013. JAMA Oncol 2015;1:505-27.
7. Hernández Hernández JR, Heras Gómez F, Cordovilla Pérez MR,
Antolín García T, Bollo de Miguel E y Grupo de Estudio CB 07-
SOCALPAR. Incidencia del carcinoma broncopulmonar en Castilla-
León y Cantabria durante el año 2007. Estudio de la Sociedad
Castellano-Leonesa
(SOCALPAR). Arch Bronconeumol 2010;46:7-14.
8. Grupo de Estudio del Carcinoma Broncopulmonar de la SOCALPAR.
Incidencia del carcinoma broncopulmonar en Castilla-León durante el
año 1997. Estudio multicéntrico de la Sociedad Castellano-Leonesa de
9. Instituto de Salud Carlos III. Servicios Científico-Técnicos.
Epidemiología. Ariadna. Mortalidad por Cáncer y otras causas. Disponible en: http://www.isciii.es
10. Instituto de Salud Carlos III. Servicios Científico-Técnicos.
Epidemiología. Raziel. Mortalidad por todas las causas. Disponible en: http://www.isciii.es
11. Abellán García A, Ayala García A. Un perfil de las personas
mayores en España, 2012. Indicadores estadísticos básicos. Madrid, Informes Portal Mayores, nº 131. [Fecha de publicación: 1/06/2012].
12. Janssen-Heijnen MLG, Coebergh JWW. The changing epidemiology of lung cancer in Europe. Lung Cancer 2003;41:245-58.
13. INE. Productos y servicios. Publicaciones. Colecciones cifras INE. Extranjeros en la UE y en España. Disponible en http://www.ine.es
14. Cayuela A, Rodríguez-Dominguez S, López-Campos JL, et al.
mortality in Spain: estimating the future burden to the year 2028. Int J Tuberc Lung Dis 2011;15:1117-21.
Tabla 1. Cáncer de pulmón. Tasas de incidencia ajustadas por edad a
la población mundial estándar calculadas para 2012 en diversas
zonas. Tomadas de la referencia número 4.
Zonas más desarrolladas
Zonas menos desarrolladas
Tabla 2. Tasas brutas de mortalidad por cáncer de pulmón en
hombres, año 2013. Provincias españolas con mayores y menores
valores. Tomadas de la referencia número 9.
Tabla 3. Tasas brutas de mortalidad por cáncer de pulmón en
mujeres, año 2013. Provincias españolas con mayores y menores
valores. Tomadas de la referencia número 9.
Figura 1. Tasas brutas de incidencia del CP, por grupos de edad y
sexo en Castilla y León. Año 2007.
OXIGENOTERAPIA DOMICILIARIA: NO SOLO OXÍGENO
Salvador Díaz Lobato, Sagrario Mayoralas Alises.
Servicio de Neumología. Hospital Ramón y Cajal. Madrid.
Aspectos clínicos
Cuando el científico y teólogo Inglés Joseph Priestley descubrió el
oxígeno (O2) en 1772 calentando óxido de mercurio al calor del sol, no podía imaginar cuán importante sería aquel hallazgo. Se había
interesado por el gas que burbujeaba en una cervecería cercana a su
casa. Al calentar óxido de mercurio obtuvo dos vapores. Uno se
condensó rápidamente en gotitas de mercurio. El otro lo recogió en
un recipiente y observó que aumentaba la brillantez de una llama y
que si introducía en su interior ratones vivos, se hacían muyy
vivían más Priestley inhaló este gas notando una sensación
de bienestar y lo llamó "aire desflogistizado". Este descubrimiento le
llevó a enunciar la "teoría del flogisto", según la cual toda sustancia
susceptible de sufrir combustión contiene flogisto y la combustión
consistiría precisamente en la pérdida de esta sustancia. Comunicó
sus observaciones al químico francés Antoine Laurent de Lavoisier.
Éste repitió los experimentos demostrando que la sustancia
descubierta por Priestley se encontraba en el aire y en el agua y la
denominó "oxígeno", del Griego "oxygenes", que significa formador
de ácidos. Lavoisier demostró que la combustión es un proceso en el
que se produce la combinación de una sustancia con el O2, refutando la teoría del flogisto. A él le debemos el conocimiento de que el agua
está compuesta por oxígeno e hidrógeno y quizás lo más importante,
el papel del O2 en la respiración de los animales y las plantas. Estos hallazgos dieron pie a su pronta utilización con fines
medicinales. Tras una primera etapa histórica en la que el O2 se utilizaba prácticamente para todo, lógicamente con resultados
dispares, debemos a Alvan Barach su uso racional y la demostración
de su utilidad en el cor pulmonale y la insuficiencia respiratoria tanto
aguda como crónica, así como haber iniciado el camino de la
oxigenoterapia de deambulación, con el desarrollo de los primeros
dispositivos portátiles y los primeros mecanismos ahorradores de O2. Por todo ello, Barach ha sido considerado el padre de la
oxigenoterapia moderna.
A comienzos de los años 80 se realizaron dos estudios que, a pesar
de sus limitaciones, sirvieron para sentar las bases de la
oxigenoterapia continua domiciliaria (OCD) tal y como la conocemos
hoy. Hablamos del NOTT y del MRC. Los resultados de estos estudios
nos dejaron como herencia que la OCD hay que prescribirla a
pacientes con EPOC, que hayan dejado de fumar, realicen
tratamiento médico pleno y que en condiciones de estabilidad clínica,
presenten cifras de PaO2 a nivel del mar inferiores a 55 mmHg o entre 55 y 60 mmHg si existen datos de daño por hipoxia (arritmias, cor
pulmonale, insuficiencia cardíaca derecha, poliglobulia o alteraciones
en la función intelectual). Estos criterios para la prescripción de
oxigenoterapia continua han sido recogidos desde entonces por todas
las guías de OCD y así aparecen igualmente en la recientemente
publicada normativa SEPAR sobre "Oxigenoterapia continua
domiciliaria" o en las recomendaciones para la prescripción de
terapias respiratorias domiciliarias. En estos pacientes, la utilización
de oxígeno un mínimo de 15 horas al día mejora la supervivencia y la
calidad de vida. Además, la oxigenoterapia continua reduce la
insuficiencia cardíaca derecha originada por el cor pulmonale, mejora
la función neuropsicológica y aumenta la tolerancia al ejercicio y la
capacidad para realizar actividades de la vida cotidiana.
Es imprescindible conocer que la administración de O2 corrige la hipoxemia solo durante su aplicación, sin que tenga efecto residual.
Cuando se suprime el aporte suplementario de O2 reaparece la hipoxemia, de ahí que sea necesario mantener la oxigenoterapia un
mínimo de 15 horas al día para conseguir los efectos beneficiosos de
esta terapia. Es importante igualmente conocer que la indicación de
oxigenoterapia continua en pacientes con hipoxemia grave se
establece por su efecto sobre la supervivencia. En todos los casos, la
indicación de la OCD se debe considerar tras comprobar la existencia
de insuficiencia respiratoria en dos gasometrías separadas 3
semanas, realizadas en fase de estabilidad clínica, sin que el paciente
haya tenido agudizaciones en al menos tres meses. El flujo de O2 prescrito debe ser suficiente para conseguir una PaO2 por encima de 60 mmHg ó 90 % de saturación arterial de hemoglobina (SpO2), sin que ello desencadene hipercapnia ni acidosis aguda. Por último, se
debe reconsiderar la indicación de OCD en aquellos pacientes que
pese a cumplir los requisitos necesarios, siguen fumando, tienen una
historia clara de mal cumplimiento terapéutico o son incapaces de
manipular correctamente los sistemas de suministro de oxígeno. La
tabla 1 muestra las indicaciones de la OCD con la calidad de la
evidencia según el sistema GRADE.
En la reciente normativa SEPAR se especifican otros escenarios de
aplicación del oxígeno domiciliario. Así, la oxigenoterapia nocturna
debe recomendarse a pacientes con insuficiencia cardíaca congestiva
con respiración de Cheyne-Stokes objetivada, en los pacientes con
síndrome hepato-pulmonar que presenten insuficiencia respiratoria y
en el caso de pacientes con cefalea en racimos. Sin embargo, la
utilización paliativa de oxigenoterapia en pacientes con cáncer y
disnea ha demostrado ser menos eficaz que la administración de
Los criterios establecidos por los estudios NOTT y MRC se han
mantenido invariables a lo largo de más de 30 años a pesar de los
avances conseguidos en el tratamiento de las enfermedades
respiratorias, la incorporación de la ventilación mecánica no invasiva
domiciliaria, la identificación de los pacientes con síndrome de apnea
del sueño o la mejor discriminación de los pacientes con EPOC en la
línea de la definición de fenotipos. Todos ellos factores de confusión
en pacientes con insuficiencia respiratoria crónica. Esto ha sido
propiciado fundamentalmente por la ausencia de estudios
relacionados con la OCD durante este tiempo. Es cierto que se han
realizado tímidos intentos de valorar la eficacia de la oxigenoterapia
en pacientes con hipoxemia moderada (PaO2 55-65 mmHg), con resultados negativos sobre la supervivencia y dispares en variables
como disnea, calidad de vida, función cognitiva, hospitalizaciones o
grado de depresión. Es posible que estemos pasando por alto
variables clínicas sobre las que la OCD pudiera ser eficaz si solo nos
fijamos en la supervivencia, lo cual abre las puertas a estudios que
nos permitan conocer mejor para qué ponemos O2 a un paciente en su casa.
También se ha tocado discretamente el problema de la indicación de
O2 en pacientes con desaturación aislada en esfuerzo. Aunque la oxigenoterapia durante el ejercicio puede aumentar la tolerancia al
esfuerzo y reducir la disnea, no se ha demostrado que tenga impacto
en la supervivencia. En este escenario de incertidumbre, la normativa
SEPAR recomienda la utilización de O2 durante el ejercicio en estos pacientes siempre que se demuestre la corrección de la hipoxemia
con su administración, mejore la disnea o la tolerancia al ejercicio
objetivada mediante el incremento de la distancia recorrida en el test
de marcha de 6 minutos de al menos 25-30 metros. Dicha normativa
contempla también la administración de O2 a los pacientes con desaturación en ejercicio incluidos en programas de rehabilitación con
objeto de aumentar la duración e intensidad del entrenamiento.
En cuanto a los pacientes que presentan hipoxemia nocturna sin
insuficiencia respiratoria diurna, también se dispone de escasa
información sobre el efecto de la oxigenoterapia. La hipoxemia
nocturna se ha definido de forma arbitraria como la presencia de más
de un 30 % de la noche con SpO2 por debajo de 90%, aunque algunos autores han utilizado otros criterios más laxos. La evidencia
disponible actualmente sugiere que la oxigenoterapia nocturna no
parece mejorar la supervivencia de pacientes con EPOC que solo
tienen desaturación nocturna. La normativa SEPAR finalmente
recomienda con bajo nivel de evidencia, la utilización de la
oxigenoterapia nocturna en pacientes con desaturación nocturna
(SpO2 <90% más del 30 % del registro) y secuelas relacionadas con la hipoxia (poliglobulia o signos de insuficiencia cardíaca derecha).
Tecnología
La V conferencia de consenso en oxigenoterapia celebrada en Denver
en 1987, marcó un hito en la historia de la OCD al considerar que el
O2 debía ser utilizado tanto dentro como fuera de casa en los pacientes capaces de realizar una vida activa, consolidándose el
concepto de oxigenoterapia de deambulación. Los equipos de
oxigenoterapia destinados a tal fin debían ser ligeros y disponer de
una autonomía mínima que garantizara el suministro adecuado de O2 al paciente durante la realización de actividades lejos del domicilio.
Tras un periodo donde las botellas de O2 comprimido de pequeño tamaño eran la única posibilidad para recibir O2 fuera de casa, entró en nuestras vidas el oxígeno líquido (figura 1). En la orden de 3 de
marzo de 1999 del Ministerio de Sanidad y Consumo, se estableció
que la indicación de oxigenoterapia mediante el uso de fuentes de
oxígeno líquido solo se podía realizar en pacientes que requirieran
flujos superiores a 5 lpm de O2 y en aquellos que pudieran desarrollar una actividad laboral o con capacidad de deambulación y que no
pudieran prescindir del suministro de O2. Para comprobar la eficacia de esta modalidad de oxigenoterapia, la citada orden exigía
demostrar la mejoría de la tolerancia al esfuerzo mediante la
realización de 3 pruebas de marcha de seis minutos con y sin O2 (basal, de titulación y de evaluación de la respuesta), cuatro si se
realizaba una previa de aprendizaje.
La aparición del O2 líquido trajo otras consecuencias en paralelo. Para aumentar la autonomía de los equipos portátiles se incorporaron los
sistemas de ahorro de O2, como el catéter transtraqueal, las válvulas de demanda inspiratoria y los reservorios espiratorios, haciendo un
poco más complejo el mundo de la OCD (figura 2).
La innovación tecnológica ha puesto a nuestra disposición en los
últimos años los concentradores portátiles de O2 (CPO). Estos equipos tienen mayores posibilidades de utilización fuera de casa al depender
de baterías y suministro eléctrico. Los modelos iniciales solo
liberaban el O2 en bolos o pulsos coordinados con la inspiración. Los equipos más modernos disponen también de la opción de funcionar
con flujos continuos, aunque su rendimiento siempre es por debajo
de los 3 lpm (figura 3). Se han descrito diferencias importantes entre
los CPO en relación al volumen de oxígeno liberado en cada pulso, la
duración del pulso, la sensibilidad del trigger del CPO y la
concentración de O2 liberada al paciente. Ello nos obliga a comprobar en cada paciente que el CPO prescrito satisface sus necesidades tanto
en reposo como en actividad y obligan a regular con precisión los
parámetros del CPO. Es fundamental también conocer la dependencia
que tienen los CPO de la frecuencia respiratoria del paciente, tema
muy importante cuando hablamos de utilizarlo en ejercicio, y de la
respiración nasal, imprescindible para que el trigger pueda ser
activado (figura 4).
Como vemos, el mundo de los CPO es complejo. La normativa SEPAR
de oxigenoterapia continua domiciliaria establece que el uso del CPO
debe estar restringido a aquellos pacientes que precisan flujos bajos
de O2 (<3L/min), debiendo siempre comprobar su eficacia con una prueba de esfuerzo. En la tabla 2 se muestran las ventajas e
inconvenientes de las principales fuentes de oxígeno.
No solo oxígeno
Más allá de las indicaciones de la OCD y de la tecnología necesaria
para su implementación, hay otros aspectos de enorme relevancia
que no debemos olvidar. Hablamos de la necesidad de establecer
criterios de calidad asistencial, de la responsabilidad de los
profesionales sanitarios en la prescripción y en el control de la
terapia, de la imprescindible monitorización del tratamiento y de la
importancia de trabajar en la educación integral del paciente.
Estudios como el "COPD Patient Management European Trial"
(COMET), esponsorizado por Air Liquide Santé International, realizado
en varios países europeos, entre ellos España, nos darán información
sobre cómo puede mejorar la adherencia a la oxigenoterapia de
nuestros pacientes con EPOC a través de la implantación de un
programa domiciliario dirigido a formarlos y dotarles de herramientas,
habilidades y capacidades para conseguir el automanejo de la
Bibliografía Recomendada
1. Ortega Ruiz F, Díaz Lobato S, Gáldiz Iturri JB, García Río F,
Güell Rous R, Morante Vélez F et al. Oxigenoterapia continua
domiciliaria. Arch Bronconeumol 2014; 50:185-200.
2. Ortega Ruiz F. Oxigenoterapia crónica domiciliaria. Año SEPAR.
Arch Bronconeumol 2014;50:209-10.
3. Díaz Lobato S. García González JL, Mayoralas S. Controversias
en oxigenoterapia continua domiciliaria. Arch Bronconeumol
4. Díaz Lobato S, Mayoralas S. Perfiles de movilidad de los
pacientes con OCD. Arch Bronconeumol 2012; 48: 55-60.
5. COPD Working Group. Long-Term Oxygen Therapy for Patients
With Chronic Obstructive Pulmonary Disease (COPD). An
Evidence-Based Analysis. Ont Health Technol Assess Ser. 2012;
6. Wedzicha JA. Ambulatory oxygen for chronic obstructive
pulmonary disease (Review). Cochrane Database of Systematic
7. Petty TL, Casabury R. Recommendations of the Fifth Oxygen
Consensus Conference. Respir Care 2000; 45: 957-61.
8. Rodríguez González-Moro JM, Alcázar B, Alfageme I, Díaz
Lobato S. Protocolo SEPAR de control y seguimiento de las
Bronconeumol 2015; 2 (5): 138-155.

Figura 1: Sistema de O2 líquido. Nodriza que permite recargar la
mochila que portará el paciente. Foto extraída de la visita de un
grupo de pacientes al estadio Santiago Bernabeu, durante el 45º
Congreso SEPAR celebrado en Madrid en junio de 2012.

Figura 2: El gran problema de las fuentes de O2 portátiles es su
autonomía. ¿Cuánto O2 me quedará? es la pregunta que se hacen
continuamente todos los pacientes.
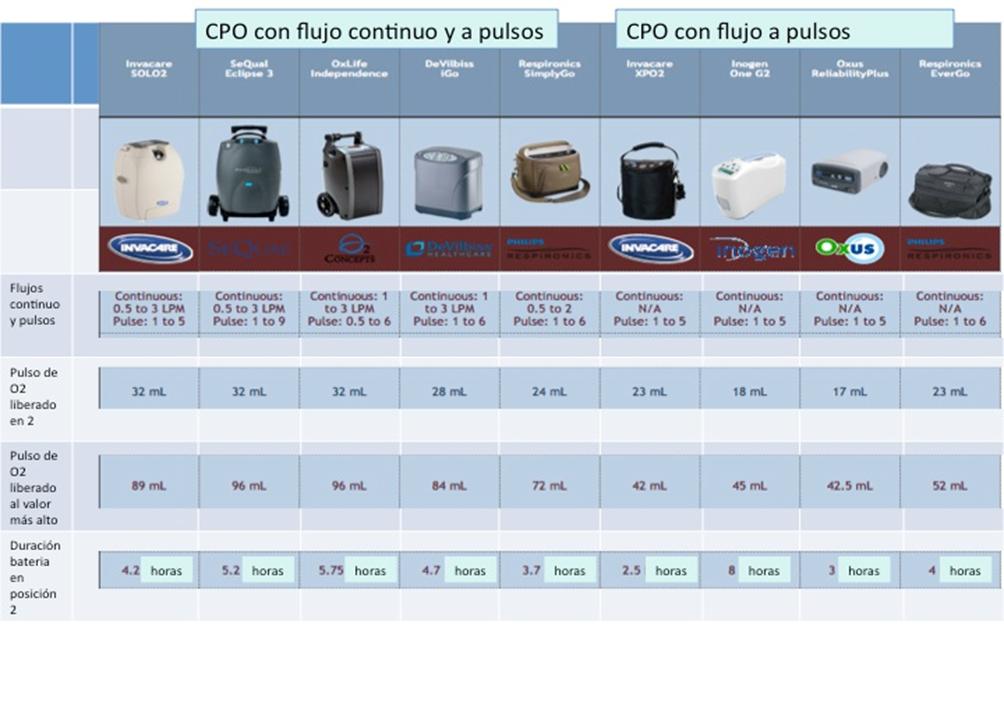
Figura 3: Características y prestaciones de los principales
concentradores portátiles disponibles en el mercado en el momento
actual. CPO: concentrador portátil.
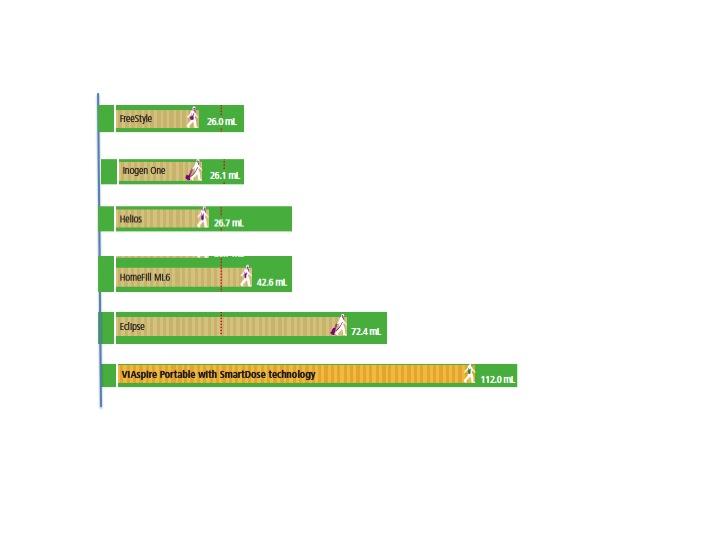
Figura 4. Volumen de O2 liberado en mL en el primer 60 % de la
inspiración durante la realización de ejercicio a 30 respiraciones por
minuto. Se pueden apreciar diferencias importantes entre los
concentradores portátiles que se muestran en la figura. (Datos
tomados de "Your 2007 Guide to Understanding Oxygen Conserving
Devices" de Valley Inspired Products. VIAspire Portable - datos del
Indicaciones de oxigenoterapia en pacientes con enfermedad pulmonar obstructiva crónica.
Oxigenoterapia continua (>15 horas/día)
Fuerza de la
Calidad de la
evidencia
Indicada para mejorar la supervivencia y calidad de vida cuando:
- PaO2 en reposo ≤ 55 mmHg (7,3 kPa), o
- PaO2 en reposo entre 56-59 mmHg (7,4-7,8 kPa)
con evidencia de daño orgánico por hipoxia (incluyendo insuficiencia cardiaca derecha, hipertensión pulmonar o policitemia)
No se recomienda en pacientes con EPOC e
hipoxemia moderada El flujo de oxígeno debe ser el suficiente para
mantener una PaO2> 60 mmHg (8,0 kPa) o una SpO2>90%
Oxigenoterapia durante el ejercicio
Puede mejorar la calidad de vida en pacientes que
experimentan desaturación durante el ejercicio (SpO2
≤ 88%) Para su prescripción se requiere la demostración que la
corrección de la hipoxemia durante el ejercicio mediante la administración de oxígeno (SpO2 ≥ 90%) se acompaña de una mejoría de la disnea o de la tolerancia al ejercicio Puede ser útil durante el ejercicio en pacientes en
programas de rehabilitación, para aumentar la duración e intensidad del entrenamiento
Oxigenoterapia nocturna
Puede considerarse en pacientes con demostración de
desaturación nocturna de oxihemoglobina (SpO2< 90% durante al menos un 30% del tiempo total de registro) y secuelas relacionadas con la hipoxia (poliglobulia o signos de insuficiencia cardiaca derecha) Se debe considerar la CPAP o la ventilación mecánica,
que puede sustituir o complementar la oxigenoterapia
Oxigenoterapia durante los viajes en avión
Se requiere una titulación específica del flujo de
oxígeno durante el sueño, ejercicio y viajes en avión
Oxígeno líquido
Ausencia de ruido.
ilimitada siempre
desde nodriza. -Indicado si se necesitan flujos > 3 L/min.
Inconvenientes -Precisa red de
eficacia con altos
flujos y cambios
en la frecuencia
respiratoria. -No indicado si se requieren flujos > 3 L/min -Ruido.
Tabla 2: Ventajas e inconvenientes de las principales fuentes de O2. L/min: litros/minuto.
BUSCANDO LA CAUSA DE LA FIBROSIS PULMONAR (IDIOPÁTICA)
Dr. Ferran Morell
Neumólogo del Vall d'Hebron. Institut de Recerca (VHIR). Barcelona
www.drferranmorell.com
Para comenzar voy a realizar un mínimo resumen histórico con el fin
de conocer cómo se inició el estudio de los pacientes afectos de
fibrosis pulmonar y, en especial para poder seguir las huellas en el
camino para conocer como hemos llegado hasta la situación
nosológica actual.
La fibrosis pulmonar era considerada en la primera mitad del siglo
pasado como el estadio clínico avanzado de muchas enfermedades
que afectaban al pulmón. Se la había conocido anteriormente como
"cirrosis del pulmón" (1) y se habían descrito casos de evolución
rápida por Hamman y Rich (2), pero se carecía de una clasificación o
de una sistematización en su estudio clínico. Fue Avery Liebow en
1969 (3) quien con su prestigioso equipo formado entre otros por los
Drs. Carrington, Gaensler y la Dra Katzenstein, quien estableció,
después de haber analizado un gran número de biopsias pulmonares
quirúrgicas, la primera clasificación de las enfermedades pulmonares
intersticiales (EPI); en este caso la clasificación original de las
llamadas neumonías intersticiales idiopáticas (NII)(3). Unos años más
tarde este mismo grupo publicó una serie de 502 casos de
enfermedades intersticiales correlacionando las biopsias pulmonares
con los datos clínicos y radiológicos (4). De este modo se
distinguieron las neumonías intersticiales usuales (NIU), las
descamativas (NID), las asociadas a bronquiolitis (NIB), las
linfoideas (NIL), las agudas (NIA) y las que cursaban con células
gigantes en su histología (NICG) (hoy día consideradas neumonitis
por hipersensibilidad).
Me comentaba Mario Saldaña, un prestigioso patólogo pulmonar de
origen peruano, que se formó en la escuela citada, que el Profesor
Liebow, tras la visualización al microscopio de las biopsias de las EPI,
en muchas de ellas le decía: "pon el informe de esta en el montón de
las usuales", es decir en el grupo de las que eran frecuentes y no
tenían las características de alguna de las otras entidades; de aquí el
nombre de usual, del que derivó el nombre de NIU. Se puede
interpretar por lo tanto que Liebow las incluía en el cajón de sastre
de aquellas idiopáticas sin las características histológicas definidas de
las otras entidades que hemos referido en la clasificación de las NII.
Así es como en la segunda década del siglo XX fuimos clasificando y
tratando, muchas veces con corticosteroides y otros fármacos, a las
diversas NII. Fue en el año 2000 cuando se publicó el consenso,
("consensus") ATS/ERS sobre la Fibrosis Pulmonar Idiopática (FPI),
donde figuraban ya como autores la inmensa mayoría de los expertos
actuales en FPI (5). En él se refiere que "la FPI es ahora reconocida
como una entidad clínica diferente" del resto de las otras EPI, y
además se la diferencia del resto de las NII. Para ello recomiendan la
práctica de una biopsia pulmonar quirúrgica en la mayoría de los
casos y propone la definición de FPI: "enfermedad de origen
desconocido, limitada al pulmón, con histología de NIU, debiéndose
excluir colagenosis, fármacos y causas ambientales" (pero no el
Así pues los expertos en EPI a la vista de su experiencia y de las
publicaciones previas de otros autores, "consensuan" los criterios que
debe cumplir un paciente para poder ser considerado como portador
de una FPI. Con esta decisión acordada dejan fuera del concepto de
FPI a aquellos pacientes con fibrosis que no siguen los criterios
histológicos de NIU.
Vemos pues que los autores del "consensus" decidieron poner el foco
en los pacientes que reunían unos determinados hallazgos en la
biopsia y/o en la TCAR, hallazgos que sirvieron para reconocer a los
pacientes con FPI. La pregunta que uno se hace es ¿qué hacemos con
las otras fibrosis que no reúnen las características de NIU en la TCAR
ni en la biopsia?, ¿son en realidad diferentes, con diferente causa y
con diferente curso?, o ¿ es que son formas evolutivas diferentes sea
por unas características de exposición diferente (más o menos
intensa), o bien mezclada o no con otras substancias, o que la
exposición se efectuó durante un mayor o menor periodo de tiempo
a la misma causa?, o es que ¿quizás las lesiones de la FPI están
producidas por una respuesta algo diferente condicionada por una
diferente genética de algunos pacientes?
A pesar de la "recomendación de efectuar una biopsia quirúrgica en la
mayoría de los casos", en el "consensus" los autores mencionan
algunos estudios en los que únicamente a un 33% de los pacientes
diagnosticados de FPI se les ha practicado biopsia quirúrgica (6) e
insisten después diciendo que, "en la mayoría de series de FPI la
biopsia quirúrgica se realiza solo en una minoría de pacientes". En
cualquier caso los autores refieren que la precisión diagnóstica de la
TCAR por expertos entrenados es de alrededor del 90%, sin embargo
acto seguido se comenta que "los expertos observadores pueden
diagnosticar con confianza meramente con una TCAR de NIU
alrededor de un 70% de los pacientes con biopsia de NIU",(7)
concluyendo ellos mismos que, un tercio de casos pueden no ser
diagnosticados si se utiliza solo la TCAR. Estas constataciones previas, permiten deducir que los diagnósticos
de FPI, sin que se haya efectuado biopsia en alrededor del 70% y con
la poca precisión de la TCAR, están basados en una incertidumbre.
Estas dudas diagnósticas se mantuvieron en los dos años siguientes,
lo que condujo finalmente a "consensuar" de nuevo unas nuevas
guías en el año 2002 sobre NII, en las que se reafirma que, para
obtener un diagnóstico de seguridad de FPI se requiere una biopsia
quirúrgica de NIU, y ya los autores refieren y aceptan que, una TCAR
de NIU puede verse en casos de asbestosis, colagenopatias,
neumonitis por hipersensibilidad y en algunos estadios avanzados de
sarcoidosis (8).
Al seguir las dudas diagnósticas al cabo de 9 años, los expertos
realizaron un nuevo posicionamiento ("statement") oficial de las
sociedades ATS/ERS/JRS/ALAT basado en una graduación de la
evidencia recientemente publicada sobre el diagnostico y el
tratamiento de FPI (9). A cada cuestión especifica (o tratamiento)
sobre esta evidencia los autores de las guías la calificaban por
votación de alta, moderada, baja o muy baja, efectuando
posteriormente una recomendación que podía ser " si fuerte, si débil,
o no fuerte, no débil". Realmente uno puede deducir que establecer
las normas para el diagnóstico de FPI no es una cuestión sencilla. En
definitiva, que establecer la calificación de fibrosis tipo FPI o no FPI
no ha sido una tarea fácil, y en la práctica diagnosticar al paciente en
uno u otro lado, a pesar del triángulo radiólogo, patólogo, neumólogo,
en cada centro experto es y será muchas veces incierto.
En esta ocasión el "statement" (posicionamiento) (9) refiere que,
después de excluir otras causas conocidas de EPI, se puede
diagnosticar de FPI meramente con una TCAR característica (o con la
combinación de TCAR y biopsia). En todo caso los autores en un
reconocimiento de que las imágenes de la TCAR pueden no ser tan
típicas, las dividen en patrón (definitivo) de NIU y en patrón de
posible NIU (y de no NIU) tal como vemos en la tabla 1.
Tabla 1. TCAR Criterios para catalogar el patrón NIU
osible patrón NIU
Patrón inconsistente con NIU
(cualquiera de los 7)
Predominio subpleural,
Predominio subpleural,
Predominio superior o medio.
Predominio peribroncovascular.
Anormalidad reticulares. Imágenes extensas en vidrio
deslustrado (> que reticular).
Patrón en panal.
características de patrón Micronódulos profusos
(bilaterales, predominio apical)
características de patrón
Quistes (múltiples, bilaterales,
inconsistente (ver 3ª
Mosaico (bilateral, en 3 o más
lóbulos) Consolidación en
segmentos/lóbulos
También los criterios diagnósticos de NIU por biopsia (tabla 2) los
dividen en patrón (definitivo) de NIU, de posible NIU, probable NIU y
Tabla 2. Criterios histopatológicos de NIU1
(cualquiera de los 6
Fibrosis marcada/ Fibrosis marcada/ Afectación
Membranas hiliares*
Distorsión de la
Distorsión de la
Neumonía organizada*†
fibrosis con o sin
Marcada inflamación
intersticial fuera del
Ausencia de otros Cambios
criterios de NIU
predominantemente
fibrosblásticos,
(ver 1ª columna)
centrolobulillares
fibrosis parcheada pero no de ambos
Otros cambios que
sugieren un diagnóstico
fibroblásticos.
características en
contra de NIU que
dianóstico (ver 4ª columna)
*Pueden asociarse a exacerbación de la FPI. †Un granuloma aislado y/o un ligero componente de neumonía organizada muy raramente coexisten con un patrón de NIU
Todos estos criterios del Posicionamiento ("statement") (9) de nuevo
impresionan al neumólogo que los ha de usar, al comprobar que las
normas diagnósticas de FPI no son fáciles de aplicar en la práctica (y
en la teoría) al estar asentadas en un terreno inseguro, ya que como
hemos visto, los criterios diagnósticos han sido de difícil
sistematización para los expertos en FPI. Uno puede imaginar las
dificultades diagnósticas que tendrán los especialistas en EPI que no
son tan expertos.
En muchas ocasiones he comentado en las sesiones de nuestro
Servicio de Neumología que uno debe recordar siempre, que las
clasificaciones y subdivisiones de las diferentes enfermedades las han
realizado los propios médicos con el fin de entendernos entre
nosotros y poder diagnosticar la enfermedad concreta que padece el
individuo que estamos tratando. Pero esta clasificación, en muchos
casos tiene algo de arbitraria ya que las enfermedades no son
compartimentos estancos, sino que los límites entre una y otra
entidad en muchas ocasiones pueden no ser tan definidos y lo que
hemos separado para entendernos, en realidad pueden tener muchos
puntos en común.
EN DEFINITIVA
Por las publicaciones y guías efectuadas por los expertos en FPI, se
puede deducir que la práctica clínica ha conducido a intentar separar
a los pacientes afectos de fibrosis pulmonar, en unos individuos que sí
cumplen en mayor o menor grado unos criterios, que han tenido que
subdividirse tanto desde el punto de vista de la TCAR como de la
histología, posiblemente porque los criterios típicos los cumplen solo
una parte reducida de pacientes. A este grupo de pacientes, en cada
centro con interés en las EPI, tras un nuevo "consenso" de los especialistas que forman el trípode radiólogo, patólogo y neumólogo,
se les calificará o no de idiopáticos: de FPI o de No FPI.
Uno se pregunta por la situación de los pacientes con fibrosis
pulmonar que no cumplen los criterios de FPI. De hecho son también
idiopáticos, porque en caso contrario hubiesen sido diagnosticados de
neumonitis por hipersensibilidad o de asbestosis, de colagenopatía,
fibrosis (enfisema) por tabaco etc. A estos se les debería diagnosticar
de fibrosis pulmonar idiopática no NIU. Son aquellos pacientes que
los expertos califican de fibrosis pulmonar inespecífica. Las cuestiones
que surgen son: ¿estos pacientes tienen un curso diferente de los
calificados finalmente como NIU?, ¿no se les tiene que probar los
fármacos al uso: corticosteroides, antifibróticos etc.? Es posible que
estos pacientes puedan tener unas mismas causas que los afectos de
FPI, aunque cursan con unas manifestaciones clínicas algo diferentes,
sea porque la entrada de la noxa ha sido más o menos masiva o ha
tenido lugar en un espacio de tiempo más largo, o ha entrado en el
árbol respiratorio mezclada con otras substancias que hacen que la
respuesta sea diferente, o quizás que esta respuesta y sus
manifestaciones clínicas sean diferentes a consecuencia de una
genética/respuesta inmunológica distinta.
Además, si tenemos en cuenta que ya está bien establecido que
algunas FPI son en realidad neumonitis por hipersensibilidad crónicas
(10, 11) y que si se efectúa un exhaustivo estudio diagnóstico incluso
la mitad de las FPI demuestran ser neumonitis por hipersensibilidad
(NH), está aún más en duda la separación en FPI/NIU de las fibrosis
que no cumplen criterios de NIU, ya que en este último grupo la
posibilidad de NH es aún mayor.
Así pues, nuestra propuesta es un nuevo paradigma para el estudio
de los pacientes con fibrosis pulmonar, tanto si tienen criterios de NIU
como si no los cumplen. Se trata de estudiarlos desde el punto de
vista etiológico con el fin de demostrar si son en realidad NH, son
fibrosis por tabaco, asbestosis etc. Para ello se debe tener organizado
en los centros de referencia el estudio completo, que consistirá en
realizar una exhaustiva y repetitiva historia clínica efectuada por el
experto, una analítica que incluya los anticuerpos antinucleares, la
enzima conversora de la angiotensina, y muy en especial la
determinación de anticuerpos IgG específicos frente a una batería de
hongos, frente al suero (no heces) de aves y frente al extracto de
plumas. Lógicamente se realizará una TCAR y también un lavado
broncoalveolar, si es posible de dos lóbulos diferentes, junto con
criobiopsias. Si se sospecha de algún material (plumas, humedades
en la pared etc.) se procederá a un cultivo para hongos del mismo
material. Finalmente si existen fundadas sospechas de que la causa
es un material determinado, se realizará una prueba de
broncoprovocación frente a este antígeno con el fin de ratificar aún
más la causalidad del antígeno. De hecho, después de los últimos
estudios publicados la prueba de broncoprovocación en la neumonitis
(y en la fibrosis) se puede dar ya como validada (13,14).
La biopsia quirúrgica, si se sigue esta pauta, será mucho menos
necesaria y con ello evitaremos al paciente un procedimiento que, en
los pacientes con EPI ha demostrado una mortalidad del 3.4% en una
serie multicéntrica de 2.148 paciente sometidos a biopsia
quirúrgica.(15)
La importancia de efectuar un diagnóstico preciso, (16, 17) radica
entre otras cosas en poder recomendar la evitación de la causa, lo
que ha demostrado que mejora en algo el pronóstico, (18), también
en conocer mejor la evolución del paciente que tenemos enfrente y
en poder adaptar el tratamiento, ya que en caso de diagnosticar NH
crónica, será muy recomendable el uso de corticosteroides.
Osler W. Principles and practice of Medicine. New York. Appleton
Hamman L, Rich AL: Acute diffuse interstitial fibrosis of lung.
Bull John Hopkins Hospital. 1944;74:177-212.
Liebow AA, Carrington DB: The Interstitial Pneumonias; in
Simon M, Potchen EJ, LeMay M (eds): Frontiers of pulmonary
radiology. New York, Grune and Stracton 1969. Pg. 102-141.
Gaensler EA, Carrington CB. Open biopsy for chronic diffuse
infiltrative lung disease: clinical, roentgenographic, and physiological
correlations in 502 patients. Ann Thorac Surg. 1980;30:411-26.
King TA Jr. Idiopathic Pulmonary Fibrosis: Diagnosis and
2000;161:646-64.
Johnston ID, Gomm Sa, Kalra S, Woodcock AA, Evans CC, Hind
CR. The mangement of cryptogenic fibrosing alveolitis in three
regions of the United Kingdom. Eur Respir J. 1993; 6:891-3.
Swensen SJ, Aughenbaugh GL, Myers JL. Diffuse lung disease:
diagnostic accuracy of CT in patients undergoing surgical biopsy of
the lung. Radiology. 1997;205:229-34.
Travis DW. American Thoracic Society/European Respiratory
Society International Multidisciplinary Consensus Classification of the
Idiopathic Interstitial Pneumonias. This joint statement of the
American Thoracic Society (ATS), and the European Respiratory
Society (ERS) was adopted by the ATS board of directors, June 2001
and by the ERS Executive Committee, June 2001. AJRCCM. 2002;165:227-304.
Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK,
Colby TV, Cordier JF, Flaherty KR, Lasky JA, Lynch DA, Ryu JH, Swigris
JJ, Wells AU, Ancochea J, Bouros D, Carvalho C, Costabel U, Ebina M,
Hansell DM, Johkoh T, Kim DS, King TE Jr, Kondoh Y, Myers J, Müller
NL, Nicholson AG, Richeldi L, Selman M, Dudden RF, Griss BS, Protzko
SL, Schünemann HJ; ATS/ERS/JRS/ALAT Committee on Idiopathic
Pulmonary Fibrosis.
Am J Respir Crit Care Med. 2011 Mar 15;183:788-
Ohtnai Y, Saiki S, Kitaichi M, Usui Y, Inase N, Costabel U,
Yoshizawa Y. Chronic bird fancier's lung: histopathological and clinical
correlation An application of the 2002 ATS/ERS consensus
classification of the idiopathic interstitial pneumonias. Thorax 2005;
Trahan S, Hanak V, Ryu JH, Myers JL. Role of surgical lung
biopsy in separating chronic hypersensitivity pneumonia from usual
interstitial pneumonia/idiopathic pulmonary fibrosis: analysis of 31 biopsies from 15 patients. Chest 2008; 134:126-32.
Morell F, Villar A, Montero MA, Muñoz X, Colby TV, Pipvath S,
Cruz MJ, Raghu G. Chronic hypersensitivity pneumonitis in patients
diagnosed with idiopathic pulmonary fibrosis: a prospective case-
cohort study. Lancet Respir Med. 2013;1:685-94.
Muñoz X, Morell F, Cruz MJ. The use of Specific inhalation
challenge in hypersensitivity pneumonitis. Curr Opin Allergy Clin Immunol. 2013;13:151-8.
Muñoz X, Sánchez-Ortiz M, Torres F, Villar A, Morell F, Cruz MJ.
Diagnostic yield of Specific inhalation challenge in hypersensitivity pneumonitis. Eur Respir J. 2014;44:1658-65.
Han Q, Luo Q, Xie JX, Wu LL, Liao LY, Zhang XX, Chen RC.
Diagnostic yield and postoperative mortality associated with surgical
lung biopsy for evaluation of interstitial lung diseases: A systematic
review and meta-analysis. J Thorac Cardiovasc Surg. 2015; 149:1394-401.
Morell F. Fibrosis pulmonar idiopática: importancia de un
diagnóstico preciso y tratamiento. Arch Bronconeumol. 2013;49:319-
Morell F, Villar A, Ojanguren O, Muñoz X, Cruz MJ.
Hypersensitivity pneumonitis: changes in diagnosis and management,
avoiding surgical lung biopsy. Seminars in Respiratory and Critical Care Medicine. (En prensa).
Fernández Pérez ER, Swigris JJ, Forssén AV, Tourin O, Solomon
JJ, Huie TJ. Olson AL, Brown KK. Identifying an inciting antigen is
associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest. 2013;144:1644-51.
Agradezco a Rosa Lloria su ayuda en la preparación de este
NOVEDADES DESTACADAS EN LA NUEVA GEMA4.0
Dr. Vicente Plaza Moral. Coordinador del Comité Ejecutivo de GEMA. Servicio de Neumología del H. de la Santa Creu i Sant Pau de Barcelona.
En los seis años transcurridos desde la anterior edición de la GUÍA
ESPAÑOLA PARA EL MANEJO DEL ASMA (GEMA), en 2009, han aparecido
diversos aspectos, conceptuales y terapéuticos, que sin duda
constituyen el núcleo y razón de ser de la actualización de la guía, la
nueva GEMA4.0 (Arch Bronconeumol 2015;51(S1):1-68, disponible en
Las novedades de esta nueva edición de la
guía, se pueden agrupar en dos grandes apartados:
1. ORGANIZATIVAS O DE PARTICIPACIÓN.
Dado el éxito obtenido con el formato empleado en la anterior edición
(redacción escueta y clara, catalogación sencilla de la evidencia,
propuesta de recomendaciones robustas/débiles y profusión de
algoritmos y tablas), el Comité Ejecutivo de GEMA decidió no
cambiarlo en esta nueva edición de la guía. Por lo que esta nueva
GEMA, en parte es una actualización del estado del conocimiento
sobre la enfermedad basada en pruebas científicas publicadas en
revistas de prestigio. Sin embargo, incorpora cuatro nuevos capítulos
(6. Rinitis y poliposis nasal; 7. Asma y EPOC; 8. Asma grave no
controlada; y 10. Plan de difusión y de implementación), que se
consideraron, dada la relevancia que han adquirido en los últimos
años, de "obligada" presencia en el nuevo documento.
Entre otras novedades (rediseño y nuevos contenidos de la web
programa de comunicación en medios generales
de comunicación; utilización de nuevas tecnologías de comunicación,
nueva GEMA se denomina GEMA4.0. El número 4 sobrevolado, hace
referencia a que se trata de la cuarta edición de la misma y el .0
sobrevolado, a la versión inicial de sucesivas actualizaciones o
versiones (telemáticas), que con este formato se efectuarán en el
futuro, en adelante, GEMA4.1, GEMA4.2, y así sucesivamente. Y por
otro lado, se ha procedido a modernizar el logo de la iniciativa, que
representa una sección transversal de un bronquio inflamado,
superpuesto a su vez a la sección transversal de dos diamantes (o
gemas) en diferentes ángulos de rotación. En nuestra opinión, de
forma imaginativa y moderna, aglutina los dos conceptos clave del
proyecto: el asma y la guía de práctica clínica, GEMA.
Esta nueva edición sigue la misma "filosofía" de sus predecesoras:
elaborar una guía de práctica clínica en asma, dirigida a profesionales
sanitarios eminentemente asistenciales, muy práctica, independiente
y consensuada entre el mayor número posible de expertos
provenientes de las diversas sociedades científicas españolas
implicadas en la asistencia de la enfermedad. Por su envergadura,
participantes, diseño y contenido esta nueva GEMA4.0 nace con las
mejores perspectivas. Además de los expertos provenientes de las
sociedades científicas y grupos que participaron en la pasada edición
(Sociedad Española de Neumología y Cirugía Torácica; Sociedad
Española de Alergología e Inmunología Clínica; Sociedad Española de
Inmunología Clínica, Alergología y Asma Pediátrica; Sociedad
Española de Medicina Familiar y de la Comunidad; Grupo de
Respiratorio de Atención Primaria; Sociedad Española de Médicos de
Atención Primaria; Sociedad Española de Medicina General; Sociedad
Española de Neumología Pediátrica, y Sociedad Española de
Otorrinolaringología), en la actual se han incorporado representantes
de la Sociedad Española de Pediatría Extrahospitalaria y Atención
Primaria, Sociedad Española de Farmacología Clínica, Sociedad
Española de Medicina de Urgencias y Emergencias, Sociedad Española
de Farmacia Comunitaria y Federación Nacional de Asociaciones de
Enfermedades Respiratorias, en representación de los pacientes. En
total, en su redacción y revisión han participado 102 expertos en
asma, representantes acreditados de 15 sociedades, grupos
científicos o asociaciones. Por el número de participantes y
sociedades en el consenso, esta nueva GEMA4.0, será la mayor
realizada hasta la fecha y probablemente el consenso multidisciplinar
más numeroso efectuado en nuestro ámbito geográfico.
2. ASPECTOS TERAPÉUTICOS
Tratamiento de mantenimiento. Ver la Figura 1, en donde se
resume el tratamiento del asma del adulto en 6 escalones y se
destacan las novedades terapéuticas.
El tratamiento de elección del asma persistente leve (escalón 2) es la
administración en monoterapia de un glucocorticoide inhalado (GCI
(recomendación 3.4 [R1]). Como novedad la guía enumera todos los
GCI disponibles en nuestro ámbito geográfico, beclometasona,
budesónida, ciclesonida, fluticasona y mometasona. Adjunta también
una nueva tabla de equipotencia de las dosis de estos GCI (Figura 2).
El tratamiento del asma persistente moderada (escalones 3 y 4)
continúa siendo la combinación de un GCI y un agonista beta2-adrenérgico de acción larga (LABA) (recomendación 3.5 [R1]),
administrados preferiblemente en un mismo dispositivo; la guía
recoge las nuevas combinaciones disponibles en la actualidad:
fluticasona
beclometasona/formoterol, fluticasona propionato/formoterol, y
fluticasona furoato/vilanterol. Otro aspecto novedoso citado es que,
desde este nivel de gravedad (escalón 3), la combinación
budesónida/formoterol o beclometasona/formoterol, se pueden
utilizar como tratamiento de mantenimiento y a demanda (alivio), sin
cambiar de dispositivo (recomendación 3.7 [R1]).
En el tratamiento del asma persistente grave (escalones 5 y 6), la
mayor novedad descansa en la incorporación de tiotropio inhalado al
arsenal terapéutico del asma. De tal forma que aquellos pacientes
insuficientemente controlados con una combinación de un GCI a
dosis altas más LABA y que tengan un FEV1/FVC postbroncodilatador ≤70%, la adición de tiotropio mejora la función pulmonar y reduce
las exacerbaciones (recomendación 3.9 [R2]).
Se incluye en la nueva edición de la guía, dentro del apartado de
otros aspectos a considerar en el tratamiento de mantenimiento,
como la educación, conductas de evitación y tratamiento de las
comorbilidades, el tratamiento farmacológico de la rinitis asociada al
asma en todos los pacientes (Figura 1).
La nueva GEMA4.0 enumera los dispositivos hoy disponibles para la
administración de fármacos inhalados. Concretamente, inhalador
presurizado convencional (pMDI), que se puede utilizar con o sin
cámara espaciadora, el sistema Modulite®, el inhalador de vapor
suave (SMI) Respimat®, los dispositivos de polvo (DPI): Accuhaler®,
Handihaler®, Nexthaler®, Spiromax®, Turbuhaler® y Twisthaler®,
así como los nebulizadores (jet, ultrasónicos o de malla vibrante).
Síndrome de solapamiento asma y EPOC. Uno de los
aspectos novedosos de la guía ha sido la incorporación de un nuevo
capítulo para abordar dicho síndrome. La GEMA4.0 propone una
actuación diagnóstica diferencial, en comparación con otras
propuestas (GesEPOC, GINA/GOLD) (ver Figura 3) y entre las
novedades terapéuticas, recomienda como tratamiento de elección la
combinación de un GCI y un LABA. En caso de respuesta insuficiente,
se añadirá tiotropio (recomendación 7.3 [R1]). Finalmente, se podría
considerar la adición de roflumilast.
Asma grave no controlada (AGNC). Dada la relevancia de
los nuevos aspectos conceptuales (fenotipos) y terapéuticos de este
particular tipo de asma, la nueva GEMA le ha dedicado un capítulo
específico. Probablemente uno de los más importantes de la guía, en
particular para neumólogos y otros especialistas.
Entre las novedades terapéuticas, además de considerar la adición
inicial de tiotropio a una combinación a dosis altas de GCI/LABA,
antes comentada, se recomienda la clasificación de estos pacientes
según su fenotipo clínico-inflamatorio. Su identificación puede
conllevar tratamientos diferenciales (recomendación 8.2 [R2]).
Concretamente, en:
_ asma alérgica de inicio precoz, se recomienda el tratamiento
con omalizumab o glucocorticoides (recomendación 8.7 [R1])., y
como posibles futuros fármacos, anticuerpos anti IL-13
(lebrikizumab y tralokinumab).
_ asma eosinofílica de inicio tardío, antagonistas de los receptores
de los leucotrienos (recomendación 8.7 [R1]), y quizá en el
futuro anticuerpos anti IL-5 (mepolizumab, reslizumab y
benralizumab).
_ asma asociada a obesidad, reducción ponderal (recomendación
_ asma neutrofílica de inicio tardío, se podría considerar la
administración de azitromicina oral de forma prolongada
(recomendación 8.7 [R2]).
Otras novedades terapéuticas del AGNC la constituyen: la indicación
de triamcinolona im. en pacientes con asma corticodependiente
(recomendación 8.8 [R2]); y en los que además cursan con limitación
crónica del flujo aéreo (FEV1 >50% y < 80%), se podría considerar la termoplastia endobronquial, en centros con experiencia en la atención
del AGNC y por endoscopistas entrenados (recomendación 8.9 [R2]).
Rinitis y poliposis nasal. La mayor novedad terapéutica en el
tratamiento de la rinitis que la guía recoge es la recomendación de
utilizar una combinación tópica nasal de glucocorticoide y
antihistamínico (propionato de fluticasona y azelastina), en un solo
dispositivo, para el tratamiento de la rinitis alérgica moderada-grave.
En pacientes con rinitis/poliposis nasosinusal y asma concomitantes
se sugiere añadir al tratamiento con glucocorticoides
intranasales, antileucotrienos o inmunoterapia con alérgenos (en el
caso de alergia) (recomendación 6.8 [R2]).
Aspectos no farmacológicos. Entre éstos cabe destacar:
En el seguimiento periódico de los pacientes debe evitarse la "inercia"
clínica y los factores que la determinan, tanto por parte del paciente,
como del profesional y del sistema sanitario.
La guía enfatiza la necesidad de evaluar el nivel de adhesión
terapéutica de los pacientes. Por ello recomienda ante un paciente
insuficientemente controlado, antes de incrementar el tratamiento
farmacológico, determinar su adherencia y confirmar el correcto uso
de sus inhaladores (Figura 1). Para la determinación de la adhesión,
GEMA sugiere utilizar la información proporcionada de la retirada de
fármacos en la farmacia (habitualmente en bases de datos
autocumplimentados (test de Morisky-Green, MARS-A o TAI)
(recomendación 3.20 [R2]).
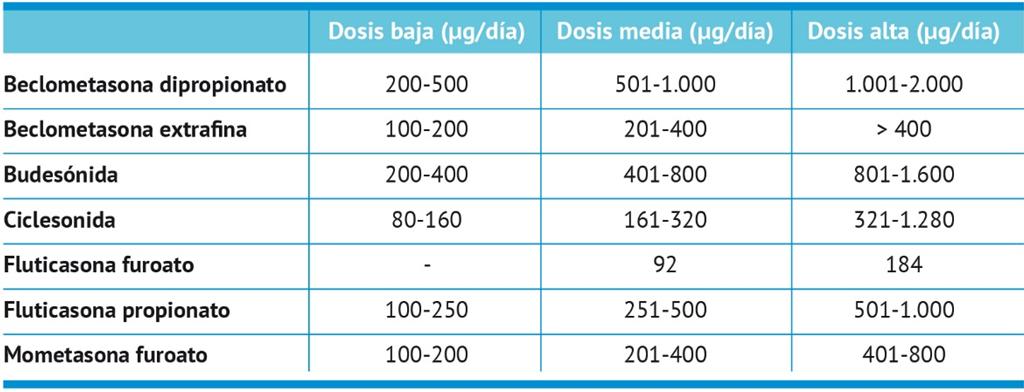
Figura 1. Resumen del tratamiento de mantenimiento del
asma del adulto. Enmarcados en color rojo las novedades
terapéuticas en relación a la edición anterior de la GEMA en 2009.
Figura 2. Equipotencia antiinflamatoria de las dosis de los
glucocorticoides inhalados comercializados en España.
Figura 3. Algoritmo propuesto en GEMA4.0 para la confirmación
diagnóstica del Síndrome de solapamiento asma y EPOC.
CAMBIOS EN LAS UNIDADES DE TRASPLANTE PULMONAR CON LOS
NUEVOS FARMACOS EN FIBROSIS E HIPERTENSION PULMONAR
José M. Cifrián Martínez
S. Neumología. Hospital Universitario Marqués de Valdecilla. Santander
AVANCES EN FPI
En los últimos 10 años se han hecho considerables avances en la
comprensión de la fisiopatología de la Fibrosis Pulmonar Idiopática
(FPI). A medida que se descubren nuevas vías patogénicas y
mediadores, las nuevas terapias en desarrollo están más enfocadas
en el papel del fibroblasto, la remodelación de tejido anormal, la
acumulación excesiva de la matriz extracelular y la angiogénesis.
Tal y como recomiendan los grupos de expertos es necesario avanzar
en seis áreas críticas de investigación: la biología de la lesión del
epitelio alveolar y la reparación aberrante de la misma; el papel de la
matriz extracelular; modelos animales de fibrosis pulmonar; el papel
de la inflamación y la inmunidad; genética, epigenética y
determinantes ambientales; la traducción de descubrimientos en el laboratorio al diagnóstico clínico y el tratamiento.
Es probable que cualquier estrategia de tratamiento eficaz para la FPI
tendrá que apuntar a más de una de las vías pro-fibróticas
estudiadas, con su compleja patogénesis, lo que permitirá el desarrollo de asociación de tratamientos.
Hasta la fecha, pirfenidona y nintedanib son los únicos tratamientos
que han mostrado un efecto significativo en el retraso de la inevitable
disminución de la función pulmonar que caracteriza la FPI. Por tanto,
el desarrollo de nuevas modalidades de tratamiento es de vital importancia.
Es destacable el papel del trasplante pulmonar como tratamiento
eficaz en la FPI, en la actualidad la primera causa de trasplante en
nuestro país. El desarrollo de tratamientos que controlen mejor los
procesos de rechazo crónico en el trasplante permitirá ofrecer una
mejor supervivencia a los pacientes que han llegado a un estadio
avanzado de la enfermedad y no tienen otras alternativas
terapeúticas. Aunque los mecanismos subyacentes de esta
enfermedad siguen siendo poco conocidos, los avances que se han
hecho hasta la fecha nos dan esperanza para el descubrimiento y el
desarrollo de modalidades de tratamiento eficaces en el futuro cercano.
AVANCES EN HAP
La hipertensión arterial pulmonar (HAP) es una enfermedad que
durante muchos años no tuvo un correcto tratamiento. Antes de
iniciarse el trasplante pulmonar la supervivencia de estos enfermos
apenas alcanzaba los tres años. Sin embargo, el inicio de los
programas de trasplante pulmonar y el uso de medicación
vasodilatadora han modificado especialmente su pronóstico. Por otra
parte, el Trasplante Pulmonar (TP) es una opción de tratamiento
utilizada en pacientes con enfermedad respiratoria crónica cuyo
número no ha parado de crecer en los últimos años, habiéndose
realizado más de tres mil el pasado año en el mundo y más de 200 en
España. De igual manera se ha llevado a cabo un espectacular avance
en el tratamiento médico de la HAP. Así, inicialmente la utilización de
epoprostenol demostró una mejoría en la sintomatología de la
enfermedad, en los valores hemodinámicos y también en la
supervivencia en su conjunto. A ello se fueron uniendo
posteriormente nuevos fármacos análogos de prostaciclina
(teprostinil, iloprost), antagonistas de receptores de endotelina
(bosentan, ambrisentan), inhibidores de fosfodiesterasa 5 (sildenafilo,
tadalafilo) y otras moléculas que son ya una realidad y abren un
horizonte esperanzador (macitentán, riociguat, selexipag). Un meta-
análisis realizado en 2009 puso de manifiesto que el tratamiento
médico suponía una importante reducción en la mortalidad. Sin duda,
esto ha significado una reducción de los pacientes incluidos en lista de
espera para trasplante en los últimos años, permaneciendo este como
la única opción viable para aquellos pacientes que no responden al tratamiento médico.
Los límites de edad se establecen en 55 años para el trasplante
cardiopulmonar, 60 para el bipulmonar y 65 para el unipulmonar. La
mayor parte de trasplantes pulmonares realizados a estos pacientes
son bipulmonares y en menor número cardiopulmonares. Los
pacientes con hipertensión pulmonar suponen el 3.2% de todos los
receptores de trasplante y un 4.9 % de todos los bipulmonares que se
realizan según los registros internacionales. Al principio de los años
ochenta se empezaron a realizar trasplantes cardiopulmonares en
pacientes con hipertensión pulmonar, posteriormente se pasó por una
época en la que predominó el trasplante unipulmonar y, finalmente, se ha impuesto el TP bilateral como técnica de elección.
Los criterios de derivación a un equipo de trasplante pulmonar son
clase funcional III ó IV (NYHA) con mala respuesta al tratamiento,
enfermedad rápidamente progresiva, y necesidad de tratamiento con
prostaciclinas endovenosas. Son criterios de inclusión en lista de
trasplante la persistencia de clase III ó IV a pesar del máximo
tratamiento médico posible, prueba de caminar durante seis minutos
inferior a 300 metros o empeoramiento progresivo, ausencia de
respuesta a epoprostenol o pauta equivalente, y signos
hemodinámicos de mal pronóstico (índice cardíaco < 2 l/min/m2 y presión media de aurícula derecha > 20 mmHg).
Con los datos disponibles se puede afirmar que la supervivencia de
los pacientes sometidos a TP por esta indicación a los cinco años del
procedimiento oscila entre el 45 y el 55%, según las series. Existe
una mayor mortalidad perioperatoria debida a las dificultades que
presenta la intervención con indicación electiva de circulación
extracorpórea y la dificultad en la recuperación de la función cardíaca,
especialmente del ventrículo derecho. Un trabajo realizado en
nuestro centro puso de manifiesto que las alteraciones en la función
y la morfología del ventrículo derecho que presenta el grupo de
pacientes con HAP se recupera precozmente tras el trasplante
pulmonar. Actualmente se admite el empleo de oxigenador de
membrana extracorpóreo (ECMO) como puente al trasplante, durante la cirugía y en el postoperatorio con buenos resultados.
Igualmente valoramos el uso del tratamiento vasodilatador durante la
cirugía del trasplante pulmonar demostrando que su uso reducía de
forma muy significativa las resistencias vasculares pulmonares, y
mejoraba el índice cardiaco y la saturación venosa mixta de oxígeno.
Estos efectos hemodinámicos pueden evitar en algunas ocasiones la entrada en circulación extracorpórea.
Los avances en el tratamiento médico de la HAP han conseguido
aumentar la vida de los pacientes pero no curar la enfermedad por lo
que debemos tener presente la posibilidad del trasplante pulmonar.
Un 27% de los pacientes incluidos en el registro español de HAP
(REHAP) fallecieron tras un seguimiento de 2.8 + 2.3 años y tan solo
un 3.5 % recibieron trasplante pulmonar, lo que claramente indica
una infrautilización de esta técnica.
Es importante conocer de forma previa a los pacientes y tener tiempo
suficiente para llegar en situación adecuada al trasplante, por ello la
conexión con la unidad de referencia de hipertensión pulmonar y el
centro trasplantador es de gran importancia para poder ofrecer el
trasplante en el momento más adecuado.
Trasplante Pulmonar en Hospital Universitario Marqués de
Valdecilla
El año pasado 285 pacientes tuvieron la oportunidad en España de
recibir un trasplante pulmonar en uno de los siete centros
trasplantadores establecidos en nuestro país. 285 personas que
padecían una enfermedad respiratoria grave, que les mantenía en una
situación de insuficiencia respiratoria, con gran dificultad para realizar
las tareas más sencillas, encontraron una posibilidad de seguir
adelante con sus vidas. Enfermos aquejados de enfisema pulmonar,
fibrosis pulmonar, fibrosis quística e hipertensión pulmonar
fundamentalmente tuvieron la oportunidad de someterse a un
tratamiento complejo, que implica una larga intervención quirúrgica y
un tratamiento con fármacos inmunosupresores de por vida. Y ello
fue posible porque hubo el gran movimiento de solidaridad que
implica la donación de órganos.
El Hospital Universitario Marqués de Valdecilla es uno de los siete
centros en este país que realiza trasplantes pulmonares en adultos,
junto con los Hospitales Valle de Hebrón (Barcelona), Puerta de
Hierro, 12 de Octubre (Madrid), La Fe, de Valencia, Reina Sofía, de
Córdoba y el Complejo Hospitalario de A Coruña. El Hospital Valdecilla
ha realizado 84 trasplantes pulmonares en los dos últimos años. Los
pacientes que han recibido este órgano proceden del País Vasco,
Asturias, La Rioja, Navarra, Norte de Castilla-León y por supuesto de Cantabria.
Más de 600 pacientes, trasplantados pulmonares, candidatos a
trasplante, o en seguimiento para un futuro trasplante, han pasado
por las Consultas de trasplante pulmonar del Hospital Valdecilla
durante 2014, un 90% procedentes de comunidades autónomas
diferentes a la cántabra. En el momento actual se está haciendo un
importante esfuerzo de coordinación y de colaboración mutua con los
centros de procedencia que intenta conseguir un mejor seguimiento y atención del paciente trasplantado.
El programa se inició en la primavera de 1997 y se ha mantenido
activo durante más de 15 años, estando próximo a la realización de
500 trasplantes. Hoy en día, un equipo de neumólogos, cirujanos
torácicos, anestesistas, intensivistas, fisioterapeutas, rehabilitadores,
enfermeras, auxiliares, y coordinadores hace posible que esta
importante tarea siga adelante. No sería posible la realización de un
trasplante sin una importante infraestructura hospitalaria, pero
fundamentalmente sin un equipo en el que es preciso trabajar al
unísono, sin protagonismos, porque solo el paciente es el auténtico protagonista.
Aproximadamente 35 enfermos se encuentran a la espera de un
trasplante pulmonar en nuestro centro, constituyendo en este
momento una de las principales preocupaciones del equipo. Son los
pacientes que se encuentran en "lista de espera". El Hospital
Valdecilla ha desarrollado un programa de donación en asistolia y está
trabajando intensamente en mejorar los cuidados del órgano
procedente del donante. Igualmente se han instaurado oxigenadores
de membrana (ECMO), que permiten trasplantar casos más complejos.
El programa de trasplante pulmonar del centro se encuentra inmerso
en un claro compromiso con la calidad, habiendo obtenido la certificación de calidad ISO 9000 en Diciembre de 2014
NUEVAS DROGAS EN HAP Y FPI
Es un antagonista dual del receptor de endotelina que fue
desarrollado mediante la modificación de la estructura del bosentán
para aumentar su eficacia y seguridad. Macitentán se caracteriza por
una unión sostenida al receptor y por un aumento de la distribución
tisular. A pesar de las posibles diferencias en la actividad del receptor,
la eficacia de los fármacos antagonistas de la endotelina en la hipertensión arterial pulmonar parece ser comparable.
SERAPHIN (Study Endothelin Receptor Antagonist in Pulmonary
Arterial Hypertension to Improve Clinical Outcomes) es la
investigación prospectiva más grande de hipertensión arterial
pulmonar disponible hasta el momento. Es un ensayo clínico fase
tres, multicéntrico, aleatorizado, doble ciego y controlado que incluyó
742 pacientes mayores de 12 años, con hipertensión pulmonar
familiar, idiopática, relacionada con enfermedad del tejido conectivo,
cortocircuitos sistémico-pulmonares congénitos, infección por virus de
la inmunodeficiencia humana, uso de drogas o exposición a toxinas.
Otros criterios de inclusión fueron: confirmación de hipertensión
arterial pulmonar por cateterismo coronario derecho, distancia
mínima de 50 m en la caminata de 6 minutos y clase funcional II, III
o IV de la OMS. Pulido et al. analizaron y confirmaron que el tratamiento a largo plazo
con macitentán redujo la morbilidad y la mortalidad en los pacientes
con hipertensión arterial pulmonar en 151 centros de 39 países entre mayo de 2008 y diciembre de 2009.
El riociguat es miembro de una nueva clase de medicamentos
llamados estimuladores solubles de la guanilato ciclasa. La alteración
en la síntesis y en la señalización del óxido nítrico a través de la vía
de la guanilato ciclasa-monofosfato está implicada en la patogénesis
de la hipertensión pulmonar. El riociguat tiene un modo de acción
dual: la estimulación directa de la guanilato ciclasa soluble
independiente del óxido nítrico, y el aumento de la sensibilidad de la
guanilato ciclasa soluble al óxido nítrico. Este medicamento, además,
aumenta el nivel de monofosfato de guanosina cíclico –GMPc–, y a su
vez produce vasodilatación, así como efectos antiproliferativos y
antifibróticos. Ghofrani et al. evaluaron el riociguat como tratamiento
oral para dos formas de hipertensión pulmonar: hipertensión
pulmonar tromboembólica crónica e hipertensión arterial pulmonar (grupos 4 y 1).
TADALAFILO MÁS AMBRISENTAN
En Agosto de 2005 MEJM publica que entre los pacientes con HAP
que no habían recibido previamente tratamiento la combinación inicial
de ambrisentan y tadalafilo resultó en un menor riesgo de "eventos
de fallo clínico" que si se hubieran tratado con monoterapia, con significación estadística.
Es una piridona con efectos antiinflamatorios, y antioxidantes con
antagonismo de los efectos del TGF β1 "in vitro". Actúa también como
un antifibrótico alterando la expresión, síntesis y acumulación de
colágeno, inhibiendo el reclutamiento, proliferación y expresión de las
células productoras de matriz extracelular. Los primeros estudios
sugirieron beneficio de pacientes con IPF tratados con el
medicamento. Posteriormente hubo dos comunicaciones desde Japón;
la primera se suspendió por el comité revisor, por encontrar
significativamente menos exacerbaciones de la FPI en el grupo
tratado. La segunda comunicó el hallazgo de una menor caída de
capacidad vital forzada (CVF) en el grupo tratado y también una
diferencia positiva en la sobrevida libre de enfermedad, ambas con
significación estadística. Hubo sin embargo objeciones metodológicas
a este ensayo. Hubo un tercer estudio internacional que comprendió
dos ensayos semejantes paralelos: uno de ellos cumplió su objetivo
primario con un resultado positivo significativo de menor caída de CVF
en el grupo tratado. El otro ensayo sin embargo no cumplió este
objetivo. Un último estudio fue publicado en mayo 2014 que
randomizó 555 pacientes con la enfermedad a recibir Pirfenidona oral
2403 mg diarios por 52 semanas o placebo y los resultados fueron
francamente positivos. Hubo una reducción del 47% en la proporción
de pacientes que tuvieron una declinación absoluta de su CVF, del
10% o más en el porcentaje de la CVF ideal, o que fallecieron y
también hubo un relativo aumento del 132.5% en la proporción de
pacientes sin declinación de CVF, una reducción en la caída de la
distancia caminada en seis minutos y una mejoría en la sobrevida
libre de progresión de enfermedad. Los efectos laterales de la droga
fueron fundamentalmente digestivos (náuseas y vómitos, dispepsia,
baja de peso), pero fueron calificados como leves o moderados y
llevaron a discontinuar la droga en sólo el 2.9% de los tratados. Hubo
también rash cutáneo en el 28% vs 9% en el grupo placebo pero se conoce la fotosensibilidad que puede provocar la droga.
Es una molécula del grupo de las tirosin kinasas que inhibe tres
kinasas: del receptor de factor de crecimiento derivado de las
plaquetas, del factor de crecimiento vascular endotelial y del factor de
crecimiento de los fibroblastos. La inhibición de estos tres factores
podría reducir el proceso fibrótico. Se publicó un estudio fase II en el
cual se comparó tres dosificaciones y placebo en 432 pacientes. La
dosis mayor redujo la declinación de la CVF, el número de
exacerbaciones y mejoró la calidad de vida. Esto fue asociado a
moderados efectos gastrointestinales y hepatotoxicidad. Estos
resultados positivos fueron muy estimulantes y dieron pie a un nuevo
estudio internacional fase III, en dos grupos grandes de pacientes
cuyos resultados se publicaron en "The New England Journal of
Medicine" en mayo de 2014. Fueron dos estudios paralelos el
IMPULSIS 1 y el IMPULSIS 2 que randomizaron 1066 pacientes. La
caída anual de la CVF fue de 114.7 ml en el grupo tratado vs 239.9
en el grupo placebo en IMPULSIS 1 y 113.6 vs 207.3 en IMPULSIS 2
y las diferencias fueron significativas. Hubo resultados discordantes
entre ambos estudios en relación al tiempo a la primera exacerbación
que no fue diferente en el primero y si fue ventajosa para la droga en
el segundo. En relación a los efectos laterales, la diarrea fue un
problema universal en ambos estudios con diferencias importantes
con el grupo placebo (61.5 vs 18.6 y 63.2 vs 18.3). Sin embargo este
síntoma sólo llevó a discontinuar la droga en menos del 5% de los pacientes.
PRINCIPALES CAMBIOS EN UNA UNIDAD DE TRASPLANTE
PULMONAR
1.- NUEVOS CONSENSOS: La publicación de un nuevo consenso sobre
"cuando remitir a pacientes a una unidad de trasplante pulmonar" por
ISHLT en 2015 establece cuando deben ser remitidas las FPI y las HAP
2.- MAYOR NUMERO DE PACIENTES REMITIDOS: La idea plasmada
por ISHLT permite avanzar que es necesario enviar antes a valoración
a estos enfermos, lo que sin duda va a hacer que se remitan mayor
número de pacientes, aun cuando esto no signifique que se vayan a realizar más trasplantes.
3.- AGRUPAN EL MAYOR PORCENTAJE DE ENFERMOS CON ESTAS
PATOLOGÍAS: el mayor número de pacientes con FPI y HAP se van a
concentrar en las unidades de trasplantes, aunque su seguimiento se
realice en otros centros. No tiene sentido la creación de unidades de
fibrosis o de hipertensión pulmonar si no se tiene en cuenta al centro trasplantador.
4.- CENTROS DE INVESTIGACION: Las Unidades de Trasplante no
pueden limitarse a realizar únicamente el trasplante. Son co-
responsables del antes y del después de estos enfermos y deben serlo
no solo a nivel clínico, sino también en el ámbito docente e investigador.
5.- PACIENTES MAS EVOLUCIONADOS Y CON MAS CONOCIMIENTOS:
La presencia de nuevos y mejores fármacos abren la puerta a poder
realizar un mayor seguimiento de estos enfermos, con más conocimientos, con más y mejores normativas.
6.- POSIBLE DISMINUCION DEL NUMERO DE TRASPLANTES: Las
unidades de trasplante van a manejar más pacientes aunque sean
menos los que finalmente necesiten un trasplante. Sin duda, la edad
límite del paciente irá evolucionando por encima de los 65 años actuales.
7.- AUMENTO DEL INTERES DE LOS CLÍNICOS: Es evidente que
cuando las posibilidades médicas de tratamiento son mayores la
enfermedad se hace mucho más accesible
8.- FAVORECE UNA NEUMOLOGIA DIFERENTE MUCHO MAS
INTEGRADORA Y MULTIDISCIPLINAR. Ambas patologías obligan a
interaccionar equipos de diferentes especialidades: neumólogos,
cirujanos, patólogos, radiólogos (FPI), pero también cardiólogos,
reumatólogos (HAP)
9.- GESTION BASADA EN LA CALIDAD DEL PACIENTE Y EL
COMPROMISO DE MEJORA CONTINUA. La presencia de una mejor
asistencia clínico-quirúrgica debe establecer un compromiso con el
paciente y con la sociedad. Las certificaciones de calidad en unidades
que manejan enfermedades graves y con alto coste deben ser un objetivo a conseguir.
10.- MAYOR CONEXIÓN ENTRE CENTROS TRASPLANTADORES Y
CENTROS REMITENTES. Todo lo anterior va a implementar el camino
ya emprendido de colaboración máxima entre los centros que remiten
enfermos a las unidades y las propias unidades de trasplante pulmonar.
1. Pharmacological treatment of idiopathic pulmonary fibrosis: from
the past to the future. Katerina M. Antoniou, George A.
Margaritopoulos and Nikos M. Siafakas. Eur Respir Rev 2013; 22: 281–291
2. Idiopathic Pulmonary Fibrosis: From Epithelial Injury to Biomarkers
– Insights from the Bench Side. Keren Borensztajn, Bruno Crestani,
Martin Kolb. Respiration 2013;86:441–452
3. Idiopathic Pulmonary Fibrosis: Pathobiology of Novel Approaches to Treatment. Toby M. Maher. Clin Chest Med 33 (2012) 69–83
4. Future Directions in Idiopathic Pulmonary Fibrosis Research. An
NHLBI Workshop Report Blackwell. Am J Respir Crit Care Med 2014 Vol 189, Iss 2, pp 214–222
5. A review of current and novel therapies for idiopathic pulmonary
fibrosis. Rokhsara Rafii, Maya M. Juarez, Timothy E. Albertson, Andrew L. Chan. J Thorac Dis 2013;5(1):48-73
6. The treatment of idiopathic pulmonary fibrosis. Hannah V.
Woodcock and Toby M. Maher.
7. Efficacy and Safety of Nintedanib in Idiopathic Pulmonary Fibrosis. Richeldi et al. N Engl J Med 2014; 370:2071-2082
8. A Phase 3 Trial of Pirfenidone in Patients with Idiopathic Pulmonary Fibrosis . King T et al. N Engl J Med 2014; 370:2083-2092
9. D'Alonzo GE, Barst RJ, Ayres SM, Bergofsky EH, Brundage BH,
Detre KM et al. Survival in patients with primary pulmonary
hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115:343-349.
10. Sitbon O, Humbert M, Nunes H, Parent F, Garcia G, Herve P et al.
Long-term intravenous epoprostenol infusion in primary pulmonary
hypertension: prognostic factors and survival. J Am Coll Cardiol 2002; 40(4):780-788.
11. McLaughlin VV, Shillington A, Rich S. Survival in primary
pulmonary hypertension: the impact of epoprostenol therapy. Circulation 2002; 106(12):1477-1482.
12. Galie N, Manes A, Negro L, Palazzini M, Bacchi ML, Branzi A. A
meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J (2009) 30 (4): 394-403.
13. Christie JD, Edwards LB, Kucheryavaya A, Benden C, Dobbels F,
Kirk R, Rahmel AO et al. The Registry of the International Society for
Heart and Lung Transplantation: Twenty-eighth Official Adult Lung
and Heart-Lung Transplantation Report. J Heart Lung Transplant. 2011 Oct; 30 (10): 1071-1132
14. Orens JB, Estenne M, Arcasoy S, Conte JV, Corris P, Egan JJ et al.
International guidelines for the selection of lung transplant
candidates: 2006 update--a consensus report from the Pulmonary
Scientific Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2006; 25:745-755.
15. Galie N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera
JA et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2009; 34(6):1219-1263.
16. Ruisánchez C, Lerena P, González-Vílchez F, González C, Zurbano
F, Cifrián J, Mons R, Vázquez de Prada J. El trasplante de pulmón
normaliza la función del ventrículo derecho en los pacientes con
hipertensión arterial pulmonar .Rev Esp Cardiol. 2010;63 Supl 3:1-217 / pág. 6
17. Vicente R, Moreno I, Soria A, Ramos F, Torregrosa S.
Intensiva. 2012. http://dx.doi.org/10.1016/j.medin.2012.06.005
18. Rabanal J.M.; Williams M.M.; Cimadevilla B.; Pardo S.; Bartolome
M.J.; Placer J.R. Effect of nebulized iloprost, inhaled nitric oxide and
oral sildenafil on pulmonary pressure during lung transplantation. European Journal of Anaesthesiology 2011; 28: 75
19. M. López-Meseguer, J. Segovia, P. Morales, J. Cifrián,J.A. Barbera,
A. Roman, P. Escribano. Lung and Heart-Lung Transplantation in
Pulmonary Arterial Hypertension and Chronic Thromboembolic
Pulmonary Hypertension. Results from the Spanish Registry. The Journal of Heart and Lung Transplantation, Vol 31, No 4S, April 2012
20. Macitentan and Morbidity and Mortality in Pulmonary Arterial Hipertensión. Pulido et al. N Engl J Med 2013;369:809-18.
21. Riociguat for the Treatment of Pulmonary Arterial Hipertensión. Ghofrani et al. N Engl J Med 2013; 369:330-340
22. Riociguat for the Treatment of Chronic Thromboembolic
Pulmonary Hypertension. Ghofrani et al. N Engl J Med 2013; 369:319-329
Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial
Hypertension . Galie et al. N Engl J Med 2015; 373:834-844
HERPES ZÓSTER: UNA COMORBILIDAD PREVENIBLE EN LA EPOC
J. L. Viejo Bañuelos
Neumólogo. Burgos.
Las comorbilidades son muy frecuentes en la enfermedad pulmonar
obstructiva crónica (EPOC) y pueden comportar problemas en el
diagnóstico y tratamiento. Un interesante estudio muestra que los
pacientes con EPOC tienen mayor riesgo de padecer herpes zóster
(HZ), aunque son escasos los trabajos que relatan la importancia
del HZ como comorbilidad de la EPOC que complica la evolución de la
enfermedad y altera la calidad de vida del paciente.
HZ es una enfermedad causada por la reactivación del virus varicela-
zoster (VVZ) a partir de una infección latente. Se trata de uno de los
virus más frecuentes en la especie humana. En la reactivación de la
infección por el VVZ aparece la lesión cutánea característica local. La
neuralgia postherpética (NPH) es la complicación más frecuente del
HZ y se caracteriza por dolor persistente en el área afectada.
La vacuna frente al HZ disponible actualmente en España está
compuesta por la misma cepa vacunal de la varicela, la cepa OKA. La
eficacia clínica y seguridad de la vacuna (Zostavax) se analizó en el
"Shingles Prevention Study" que demostró un descenso de la carga
de enfermedad del 61,1% con disminución del 66,5% en la incidencia
Herpes Zóster.
Herpes zóster (HZ) es una enfermedad neurocutánea causada por la
reactivación del virus varicela-zóster (VVZ) a partir de una infección
latente en los ganglios sensoriales. El VVZ pertenece a la familia
Herpesviridae siendo el más agresivo de los alfa-herpesvirus, entre
los que se incluyen también los virus Herpes simplex 1 y 2 menos
virulentos.(1) Se trata de uno de los virus más frecuentes en la
especie humana y muy ubicuo pues hasta un 95% de la población ha
sido infectada ya antes de los 18 años. Tanto la fuente de infección
como el reservorio son exclusivamente humanos. Además, es
altamente contagioso y su transmisión se produce por el tracto
respiratorio o por contacto. Una vez que infecta al individuo se
desplaza a lo largo de los axones neuronales para llegar a los
ganglios sensitivos y establecer la fase de latencia(2). A pesar de que
produce una importante respuesta humoral protectora, la inmunidad
celular juega un papel esencial en la contención del virus en las fases
de latencia impidiendo su reactivación. (Figura 1).
El sistema de vigilancia inmunológica funciona gracias a continuas
exposiciones al virus tanto exógenas como debidas a la propia
situación de latencia. Es conocida la menor incidencia de HZ en
adultos que trabajan habitualmente con niños o en la exposición
natural al VVZ(3). Con la edad disminuye la operatividad del sistema
inmune al igual que ocurre con las alteraciones patológicas de la
inmunidad celular (infección por VIH, neoplasias, tratamientos
citotóxicos) lo que provoca un aumento notable de la incidencia de
algunas infecciones y entre ellas de HZ.
Las pruebas científicas disponibles parecen indicar que la inmunidad
frente al VVZ se refuerza periódicamente por la exposición al virus
salvaje o como consecuencia de una reactivación silenciosa del virus
latente que no daría lugar al cuadro clínico de HZ pero reforzaría la
inmunidad celular frente a este virus(4). La aparición de segundos
episodios de HZ en un mismo paciente es un hecho bastante
infrecuente y reservado casi exclusivamente a enfermos
inmunodeprimidos. La reactivación clínica del virus daría lugar a un
refuerzo de la inmunidad celular que protegería al individuo que ha
padecido la enfermedad frente a la ocurrencia de nuevos episodios en
En la reactivación de la infección por el VVZ aparece la lesión cutánea
local de característica distribución metamérica. De uno a cuatro días
antes existen unos pródromos que varían desde un prurito leve hasta
sensación de ardor u hormigueo e incluso dolor intenso constante o
intermitente. Este dolor en ocasiones sugiere otros diagnósticos
relacionados con su localización (afectación pleural, infarto,
colecistitis, apendicitis, hernia discal) y se acompaña de hiperestesia
de la piel que rodea la metámera afectada(5). En la edad pediátrica estas manifestaciones no son tan frecuentes ni intensas.
Las primeras lesiones suelen iniciarse en el punto más cercano al
sistema nervioso central, para en días sucesivos ir apareciendo
nuevas lesiones siguiendo el trayecto del nervio. En 48 a 72 horas las
vesículas se vuelven purulentas y en 7 a 10 días evolucionan a
costras pardo-amarillentas que pueden persistir durante 2-3 semanas
dejando eritema, pigmentación y a veces cicatrices deprimidas(6).
Aunque el HZ puede afectar a cualquier raíz nerviosa, las
localizaciones más prevalentes son: torácica (más del 50% de los
casos), cervical (10 a 20%), y territorio del trigémino (15%). Por otra
parte, el HZ se presenta con mayor frecuencia en pacientes
inmunodeprimidos, siendo en éstos más grave, con mayor tendencia
a la diseminación hematógena y a afectación cutánea generalizada.
Neuralgia postherpética (NPH).
Es la complicación más frecuente del HZ y se caracteriza por dolor
persistente en el área afectada. Uno de cada 5 pacientes mantiene
dolor a los tres meses del HZ y un 15% lo sigue comunicando a los
dos años(7).La persistencia es mucho más frecuente en las personas
ancianas(8). Se ha relacionado la aparición de NPH con la edad
avanzada y la gran intensidad del dolor prodrómico. La incidencia
parece ser mayor en mujeres y se invocan factores genéticos que
cada día adquieren mayor importancia. No existe por el momento un
tratamiento único que mejore completamente el dolor a estos
HZ y calidad de vida.
Se ha demostrado una estrecha correlación entre la intensidad del
dolor, los índices de calidad de vida y la situación funcional medida
según la repercusión sobre las actividades de la vida diaria. Autores
como Coplan y cols(9) mostraron que existía una buena correlación
entre la intensidad del dolor máximo, el deterioro en las actividades
de la vida diaria y un empeoramiento en los índices de calidad de vida
medidos con los instrumentos EuroQol y SF-36.
EPOC y comorbilidades.
Las comorbilidades son muy frecuentes en la EPOC y pueden
comportar problemas en el diagnóstico y el tratamiento. También es
posible que algunos tratamientos destinados a las comorbilidades
puedan tener un efecto beneficioso sobre el curso de la EPOC. En la
actualización de la guía española de la EPOC, GesEPOC, publicada en
2014(10) se señalan las comorbilidades más importantes.
En un estudio llevado a cabo en una área de Madrid(11) con una
población de casi 200.000 personas, atendidas por 129 médicos de
familia, se observó una prevalencia de EPOC diagnosticada de un
3,2% entre la población mayor de 40 años, con un 90% de los
pacientes con comorbilidades asociadas a la EPOC y una media de 4
enfermedades crónicas por paciente. Tras ajustar por edad y sexo, se
observó una prevalencia mayor de la esperada de 10 enfermedades
crónicas: insuficiencia cardíaca, enfermedad hepática crónica, asma,
arteriosclerosis,
ansiedad/depresión, arritmias y obesidad.
En otro estudio de pacientes hospitalizados por agudización de
EPOC(12) se empleó el índice de Charlson para cuantificar las
comorbilidades y se observó que dicho índice fue un predictor
independiente de mortalidad, incluso tras ajustar por edad, función
pulmonar y estado funcional general según el índice de Katz. Por
último, aunque no se trate de un trabajo original, conviene destacar
una reciente revisión en la que se actualizan los conocimientos de las
importantes(13).
comorbilidades más frecuentes de la EPOC junto con aspectos
diagnósticos y terapéuticos se presenta en la FIGURA 3.
En ninguno de los trabajos citados se menciona la importancia del HZ
como comorbilidad de la EPOC que complica la evolución de la
enfermedad y altera la calidad de vida del paciente. En espera de
datos que permitan incorporar nuevos índices de comorbilidad, la
evaluación de la comorbilidad en la EPOC se debe realizar de forma
individualizada(10).
EPOC y HZ.
La prevalencia de la EPOC de grado II a IV de GOLD en España es de
4,4% en población de 40 a 80 años, y se incrementa con la edad
llegando a ser el 11,6% en personas de 70 a 80 años, con un 19,7%
de los varones y 4,1% de las mujeres(14). Un interesante estudio(15)
muestra que los pacientes con EPOC tienen mayor riesgo de padecer
HZ. El seguimiento de grupos de pacientes con EPOC y sin EPOC
demostró esta clara diferencia (FIGURA 4).
Los pacientes que tomaban regularmente corticosteroides inhalados
tenían un HR ajustado de 2,09 de posibilidad de contraer HZ y en
caso de tomar corticosteroides orales esta opción se aumentaba
hasta 3,00. El cuadro de la FIGURA 5 muestra los datos de estos dos
Vacuna frente a HZ.
La vacuna disponible actualmente en España frente al HZ está
compuesta por la misma cepa vacunal de la varicela, la cepa OKA,
aunque con una carga viral de 19.400 unidades formadoras de placas
(UFP) frente a las 1.350 UFP de la vacuna de la varicela. No contiene
mercurio ni timerosal como excipientes. Su mecanismo de acción
principal es inducir un refuerzo de la respuesta inmune celular, en
especial de los linfocitos T, frente al virus varicela zóster para evitar
su reactivación(16).
La eficacia clínica y seguridad de la vacuna (Zostavax) se analizó en
el "Shingles Prevention Study"(17). La población estudiada fueron
38.546 individuos mayores de 59 años que habían pasado la varicela
o llevaban más de 30 años viviendo en EE.UU., con lo que se
consideraba que habían tenido contacto con el virus. Se incluyeron
19.270 en el grupo que recibió la vacuna y 19.276 en el grupo que
recibió placebo. Se demostró un descenso de la carga de enfermedad
del 61,1% con disminución de la incidencia de NPH en un 66,5%. La
incidencia de HZ en el grupo placebo fue de 11,2 casos por 1.000
personas-año y en el grupo vacunado de 5,42 (p<0,001) con una
eficacia vacunal global del 51%. Cuando se observa la edad hay
diferencia en la eficacia vacunal: 63,9% en el grupo de menores de
70 años frente al 37,6% en los mayores de esta edad (p<0,001). En
general la vacuna se toleró bien y los efectos sistémicos y graves
fueron muy poco frecuentes y similares, tanto en el grupo que recibió
la vacuna como en el que recibió placebo.
Un subestudio(18) de este mismo trabajo incluía a 1.397 pacientes que
fueron sometidos a controles inmunológicos, pudo demostrar que la
vacunación refuerza de forma importante la inmunidad humoral y
celular frente al virus VZ. A las seis semanas los títulos de
anticuerpos se habían doblado en los sujetos vacunados en
comparación con los del grupo control, hecho con significación
estadística. Estos niveles de inmunidad se mantuvieron a los 3 años
de la vacunación. Aunque la duración de la protección tras la
vacunación no se conoce por el momento, se han demostrado al
menos 4 años de eficacia según los datos de seguimiento del estudio.
No se ha establecido por el momento la necesidad de revacunación.
La vacuna aprobada en EE.UU. en 2006 está indicada para la
población mayor de 60 años. Posteriormente la Agencia Europea del
Medicamento (EMA) aprobó su uso en 2007(19) con una indicación
posterior para mayores de 50 años. Por ello debe valorarse desde
distintos puntos de vista: epidemiología, morbilidad de la
enfermedad, eficacia, coste-efectividad, seguridad y disponibilidad de
vacuna. Fuera de nuestro país existen diversas publicaciones que
avalan la eficacia y seguridad de esta vacuna frente al HZ,
contribuyendo tanto a disminuir la incidencia de HZ y de la NPH,
como la carga de enfermedad en personas mayores de 50 años(20-21).
Se recomienda la vacunación rutinaria de todas las personas mayores
de 60 años con una única dosis de vacuna. Las personas que refieran
un episodio previo de HZ y las personas con enfermedades crónicas
(entre las que está la EPOC) pueden ser vacunadas, a menos que se
establezcan contraindicaciones o precauciones. La administración
excepcional de dos dosis de vacuna Zostavax en pacientes VIH
positivos con un recuento de células T CD4 mayor de 200/ml es
suficientemente segura e inmunogéna para la prevención del HZ. En
nuestro sistema sanitario algunas comunidades ya financian esta
vacuna para pacientes con EPOC grave, con edad entre 60 y 65 años
y que reciben corticosteroides inhalados.
La Agencia Europea del Medicamento ha considerado que en el grupo
de edad de 50 a 59 años la carga de enfermedad es suficientemente
elevada como para justificar la indicación. Además, no parece que el
beneficio/riesgo sea muy diferente en estas edades que en edades
más avanzadas. La vacuna se conserva refrigerada y se administra
por vía subcutánea preferiblemente en la región deltoidea. Está
contraindicada en la mujer embarazada y en los pacientes con
tuberculosis activa no tratada, inmunodeficinecia primaria y adquirida
y tratamiento con inmunosupresores. La vacuna puede administrarse
de forma concomitante con la vacuna de la gripe inactivada, pero
debe evitarse aplicarla simultáneamente con la vacuna neumocócica
Muy recientemente (abril 2015) se comunicaron los resultados de una
nueva vacuna(22) en un gran estudio de fase 3 que incluyó a 15.411
personas (7.698 vacunados y 7.713 tratados con placebo) para
valorar la eficacia en la reducción del riesgo de padecer HZ. Se trata,
a diferencia de la ya comentada vacuna viva atenuada, de una
vacuna de subunidades recombinantes adecuada también para
inmunodeprimidos, al prevenir el riesgo de la enfermedad resultante
de la replicación del virus. La vacuna VZV glicoproteína E se
administra con el adyuvante AS01B, antígeno esencial para la
replicación viral y la difusión célula a célula. Esta vacuna administrada
en dos dosis, obtiene en los grupos vacunados de personas mayores
de 50 años una eficacia del 97,2% frente a placebo, y una eficacia
similar en los tres grupos de edad, de 50, 60 y mayores de 70 años.
Whitley R. Varicella-zoster virus. En Mandell GL, Bennett JE eds.
Mandell Principles and Practice of Infectious Diseases, 4th edition, vol
2. New York 2000:1581-6. 2.
Chen JJ, Gershon AA, Li ZS, Lungu O, Gershon MD. Latent and
lytic infection of isolated guinea pig enteric ganglio by VVZ. J Med
Virol 2003;70 Suppl 1:S71-8.
Thomas SL, Wheeler JG, Hall AJ. Contacts with varicella or
children and protection against herpes zoster in adults: a case control
study. Lancet 2002;360:678-822.
Salleras L, Salleras M. Historia natural de la infección por el
virus de la varicela zoster. Vacunas 2009;10:125-9.
McCrary ML, Severson J, Tyring SK. Varicella zoster virus. J Am
Acad Dermatol 1999;41:1-14. 6.
Arvin AM. Varicella zoster virus: overview and clinical
manifestations. Semin Dermatol, 1996;15(2 suppl 1):4-7.
Van Vijck AJ. The PINE study for epidural steroids and local
anaesthetics to prevent postherpetic neuralgia: a randomized
controlled trial. Lancet 2006;367:219-24.
Niv D, Maltsman A. Postherpetic Neuralgia: The Never-Ending
Challenge. Pain Practice 2005;5. Issue 4:327- 40.
Coplan PM, Schmader K, Nikas A et al. Development of a
measure of the burden of pain due to herpes zoster and postherpetic
neuralgia for prevention trials: adaptation of the Brief Pain Inventory.
J Pain 2004;5:344-56.
10. Miravitlles M, Soler-Cataluña JJ, Calle M, Molina J, Almagro P,
Quintano JA, et al. Guía española de la EPOC
2014;50(supl 1):1-16.
García-Olmos L, Alberquilla A, Ayala V, García-Sagredo P,
Morales L, Carmona M, et al. Comorbidity in patients with chronic
obstructive pulmonary disease in family practice: a cross sectional
study. BMC Fam Pract. 2013;14:11.
Almagro P, Cabrera FJ, Díez J, Boixeda R, Alonso Ortiz MB,
Murio C, et al; Spanish Society of Internal Medicine. Comorbidities
and short-term prognosis in patients hospitalized for acute
exacerbation of COPD: the EPOC en Servicios de Medicina Interna
(ESMI) study. Chest. 2012;142:1126-33. 13. Rabe KF, Wedzicha JA, Wouters EFM, editores. COPD and
Comorbidity. European Respiratory Society Monograph. 2013;59. doi:
Miravitlles M, Soriano JB, García-Rio F, et al. Prevalence of
COPD in Spain: impact of undiagnosed COPD on quality of life and
daily life activities. Thorax 2009;64:863-8.
Yang YW, Chen YH, Wang KH et al. Risk of herpes zoster among
patients with chronic obstructive pulmonary disease: a population-
based study. CMAJ 2011; 183 (5)
Documento de Consenso sobre Prevención de Herpes Zóster y
Neuralgia Post-Herpética. Cisterna R. Editor. Asociación de
Microbiología y Salud. Vizcaya 2014.
Oxman MN, Levin MJ, Johnson GR, Schader KE, Straus SE,
Gelb LD, et al; Shingles Prevention Study Group. A vaccine to prevent
herpes zoster and postherpetic neuralgia in older adults. N Engl J Med
2005;352:2271-84.
18. Levin MJ, Oxman MN, Zhang JH, Johnson GR, Stanley H,
Hayward AR et al. Varicella-zoster virus-specific immune responses in
elderly recipients of a herpes zoster vaccine. J Infect Dis.
2008;197:825-35.
European Medicines Agency. Zostavax: Product information as
Murray AV, Reinsinger KS, Kerzner B. Safety and tolerability of
zoster vaccine in adults>60 years old. Human Vaccines
2011;7:11:1130-6. 21. Langan SM, Smeeth L, Margolis DJ, Thomas SL. Herpes zoster
vaccine effectiveness against incident herpes zoster and post-herpetic
neuralgia in an older US population: a cohort study. Plos Med. 2023
Ap;10(4):e1001420.
22. Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo
J, Hwang SJ, et al. for the ZOE-50 Study Group Efficacy of an
Adjuvanted Herpes Zoster Subunit Vaccine in Older Adults. N Engl J
Med 2015; April28. DOI:10.1056/NEJMoa1501184.
Figura 1. Patogénesis del HZ. De la infección primaria (varicela) a la
reactivación sintomática (herpes zóster).
HZ, la infección secundaria producida por el VVZ, ocurre cuando la
inmunidad celular específica frente a este virus desciende por debajo de unos niveles que impiden el mantenimiento de la latencia del virus.
FIGURA 2. Aspecto típico de Herpes Zóster.
Figura 3. Principales comorbilidades de la EPOC. Tomado de
FIGURA 4. HZ en pacientes con EPOC en relación a pacientes no
EPOC, seguimiento a 1.200 días. Tomado de referencia 15.
FIGURA 5. Los pacientes con EPOC de todas las edades presentaron
mayor riesgo de padecer HZ en comparación con el grupo control.
Además, los pacientes que toman corticosteroides inhalados y orales
tienen mayor posibilidad de contraer HZ. Modificado de referencia 15.
NEW CONCEPTS OF INFECTION AND THE LUNG
Antonio Anzueto, MD
Professor of Medicine at The University of Texas Health Science
Center at San Antonio. Medical Director of the Pulmonary Function
Laboratory at the University Hospital in San Antonio
Approximately 70% of exacerbations in chronic obstructive pulmonary
disease (ECOPD) are caused by respiratory infections including
bacteria (40–60%), viruses (about 30%), and atypical bacteria (5–
10%) (1, 2). For the last 25 years, the clinical criteria described by
Anthonisen and colleagues (3) have been incorporated in clinical
guidelines to help in selecting patients who require empiric antibiotic
therapy (4). More recent studies have identified a change in sputum
color or an increase in purulence as a good surrogate marker for the
presence of bacterial infection (5–7). Furthermore, only the change in
sputum color was identified as a predictor of good response with
antibiotics in a placebo-controlled clinical trial in patients with mild to
moderate COPD (8). Therefore, change in sputum color and increased
purulence are the only clinical features that help clinicians to decide
whether to use an antibiotic in ambulatory ECOPD.
Understanding of the role of bacteria during stable COPD is still
incomplete. Inpatients with stable COPD, the isolation of potentially
pathogenic microorganisms (PPMs) in respiratory samples ranges
between 20% and 60% of cases (9–11). Some studies have
suggested that these bacteria contribute to chronic airway
inflammation leading to COPD progression (9, 10, 12). Therefore, it
has been suggested that the term chronic bronchial infection would be
more appropriate when addressing the presence of significant
concentrations of PPMs in the lower airways of patients with stable
COPD (10, 13). Patients with chronic bronchial infection may
constitute an infective phenotype (10). Finally, the relevance of the
described microbiota in lung health must be established. Molecular
culture– independent techniques have identified bacteria previously
not amenable to culture. Analysis of the highly conserved 16S
ribosomal RNA gene has been used to assign phylogeny and allowed a
picture of the complete microbial community in an environment (i.e.,
upper airway, sinus, bronchial tree, etc.) to be constructed, offering a
more comprehensive analysis than classical culture-based techniques
(14) (Figure 1). The number of studies examining the lower airway
microbiome is limited and there is some overlap between bacteria
seen in COPD and healthy individuals (15) (Figure 2); however, one
study has reported a significantly different bacterial community in
patients with very severe COPD compared with nonsmokers, smokers,
and patients with cystic fibrosis (16) (Figure3). Studies are clearly
needed to understand the role of these microbiomes in healthy
individuals and patients with COPD, and furthermore, we need to
understand the impact of antibiotics, given for either acute
exacerbation or chronic disease, on these bacterial communities.
In chronically infected patients it is possible that reduction of airway
bacterial load and/or prevention of new strain acquisition by the use
of antibiotics may reduce the frequency and severity of exacerbations.
The potential role of long-term antibiotic therapy in the management
of COPD was first investigated in trials conducted during the 1950s
and 1960s. However, these studies were limited by small patient
numbers, use of low doses of narrow spectrum antibiotics, and
inadequate efficacy measurements. Concerns over the potential for
developing bacterial resistance further hampered investigation into
the value of this treatment (17). Nevertheless, emergence of new
antibiotic formulations with improved sensitivities coupled with
increased understanding of the pathogenesis of COPD has led to
renewed interest in the role of long-term antibiotic use in the
management of the condition, although no agents are currently
licensed for such therapy in COPD. Recent studies have evaluated the
use of prophylactic antibiotics in non-cystic fibrosis bronchiectasis and
their impact on lung microbiota. Rogers et al (18) demonstrated that
using long-term erythromycin treatment changes de respiratory
microbiota in patients with bronchiectasis. In patients without P
aeruginosa airway infection erythromycin did not significantly
reduce exacerbations and promoted displacement of H influenza
by more macrolide-tolerant pathogens including P aeruginosa. These
data suggest for a cautious approach to chronic macrolide use in
patients without P aeruginosa airway infection and in other conditions like COPD.
Reference:
Sethi S. Infectious etiology of acute exacerbations of chronic
bronchitis.Chest 2000;117(5, Suppl 2)380S–385S.
• Papi A, Bellettato CM, Braccioni F, Romagnoli M, Casolari P,
CaramoriG, Fabbri LM, Johnston SL. Infections and airway
inflammation in chronic obstructive pulmonary disease severe
exacerbations. Am J Respir Crit Care Med 2006;173:1114–1121.
• Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding
GKM,Nelson NA. Antibiotic therapy in exacerbations of chronic
obstructive pulmonary disease. Ann Intern Med 1987;106:196–
• Woodhead M, Blasi F, Ewig S, Garau J, Huchon G, Ieven M, Ortqvist
A,Schaberg T, Torres A, van der Heijden G, et al.; Joint Taskforce of
the European Respiratory Society and European Society for Clinical
Microbiology and Infectious Diseases. Guidelines for the
management of adult lower respiratory tract infections—full
version. Clin Microbiol Infect 2011;17:E1–E59.
• Stockley RA, O'Brien C, Pye A, Hill SL. Relationship of sputum
colorto nature and outpatient management of acute exacerbations
of COPD. Chest 2000;117:1638–1645.
• Miravitlles M, Kruesmann F, Haverstock D, Perroncel R, Choudhri
SH,Arvis P. Sputum colour and bacteria in chronic bronchitis
exacerbations: a pooled analysis. Eur Respir J 2012;39:1354–1360.
• Soler N, Agustí C, Angrill J, Puig De la Bellacasa J, Torres A.
Bronchoscopic validation of the significance of sputum purulence in
severe exacerbations of chronic obstructive pulmonary disease.
Thorax 2007;62:29–35.
• Llor C, Moragas A, Hernández S, Bayona C, Miravitlles M. Efficacy of
antibiotic therapy for acute exacerbations of mild to moderate
chronic obstructive pulmonary disease. Am J Respir Crit Care Med
2012;186: 716–723.
• Sethi S, Murphy TF. Infection in the pathogenesis and course of
chronicobstructive
2008;359:2355–2365.
• Matkovic Z, Miravitlles M. Chronic bronchial infection in COPD:
isthere an infective phenotype? Respir Med 2013;107:10–22.
• Miravitlles M, Marín A, Monsó E, Vilà S, de la Roza C, Hervás R,
Esquinas C, García M, Millares L, Morera J, et al. Colour of sputum
is a marker for bacterial colonisation in chronic obstructive
pulmonary disease. Respir Res 2010;11:58.
• Wilkinson TMA, Patel IS, Wilks M, Donaldson GC, Wedzicha JA.
Airwaybacterial load and FEV1 decline in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med
2003;167:1090–1095.
• Sethi S. Infection as a comorbidity of COPD. Eur Respir J
2010;35:1209– 1215.
• Beasley V, Joshi PV, Singanayagam A, Molyneaux PL, Johnston
SL,Mallia P. Lung microbiology and exacerbations in COPD. Int J
Chron Obstruct Pulmon Dis 2012;7:555–569.
• Sze MA, Dimitriu PA, Hayashi S, Elliott WM, McDonough
JE,Gosselink JV, Cooper J, Sin DD, Mohn WW, Hogg JC. The lung
tissue microbiome in chronic obstructive pulmonary disease. Am J
Respir Crit Care Med 2012;185:1073–1080.
• Erb-Downward JR, Thompson DL, Han MK, Freeman CM,
McCloskeyL, Schmidt LA, Young VB, Toews GB, Curtis JL, Sundaram
B, et al. Analysis of the lung microbiome in the "healthy" smoker
and in COPD. PLoS One 2011;6:e16384.
T, Black P, Chacko E, Ram FSF, Poole P.
Prophylacticantibiotic therapy for chronic bronchitis. Cochrane
Database Syst Rev 2003;1:CD004105.
• Rogers G, et al The effect of long-term macrolide treatment on
bronchiectasis: an analysis from the randomized, double-blind,
placebo-controlled BLESS trial. Lancet Resp Med 2014; 2:988-996.
Source: http://www.simposiodeneumologia.es/simposio2015/41simposiodeneumologia/!
the right choice. (888) 694-8381 www.vetone.net GenOne™ SprayTopicalGenOne is a gentamicin sulfate with betamethasone valerate topical spray that is indicated for the treatment in dogs of infected superficial lesions for bacteria sensitive to gentamicin. Each milliliter contains gentamicin sulfate equivalent to 0.57 mg gentamicin base, and betamethasone valerate equivalent to 0.284 mg betamethasone. Gentamicin, a broad-spectrum antibiotic, is a highly effective topical treatment for bacterial infections of the skin. Betamethasone valerate, a synthetic glucocorticoid, has been shown to provide anti-inflammatory and antipruritic activity in the topical management of corticosteroid-responsive infected superficial lesions in dogs. For topical use in dogs only. Prescription.
Fichas Internacionales de Seguridad Química BENZO [a] ANTRACENO ICSC: 0385 BENZO a ANTRACENO 1,2-Benzoantraceno 2,3-Benzofenantreno Masa molecular: 228.3 Nº CAS 56-55-3 Nº RTECS CV9275000 Nº ICSC 0385 Nº NU 2811 PELIGROS/ SINTOMAS PRIMEROS AUXILIOS/ PELIGRO/ PREVENCION












